题目内容
3.对于常温下pH=3的乙酸溶液,下列说法正确的是( )| A. | 与等体积、pH=3的盐酸比较,跟足量锌粒反应产生的H2更少 | |
| B. | 加水稀释到原体积的10倍后溶液pH变为4 | |
| C. | 加入少量乙酸钠固体,溶液pH升高 | |
| D. | 升高温度,溶液中所有离子浓度均增大 |
分析 醋酸为弱酸,在溶液中存在CH3COOH?CH3COO-+H+,加入水、升高温度可促进电离,增大CH3COO-浓度,平衡逆向移动,以此解答该题.
解答 解:A.乙酸是弱电解质,在溶液中部分电离,则c(CH3COOH)>c(H+),盐酸中c(HCl)=c(H+),所以等体积、等PH的二者醋酸的物质的量大,则与足量锌粒反应醋酸产生的H2更多,故A错误;
B.加水稀释到原体积的10倍后溶液pH变为4,但乙酸是弱电解质存在电离平衡,稀释促进电离,溶液又电离出氢离子,浓度增大,溶液PH小于4,故B错误;
C.乙酸钠溶于水溶液中的乙酸根离子抑制乙酸的电离,平衡左移,氢离子浓度减小,溶液PH增大,故C正确;
D.水溶液中c(H+)×c(OH-)为常数,升高温度,溶液中c(H+)增大,则c(OH-)减小,故D错误;
故选C.
点评 本题考查了弱电解质的电离平衡分析判断,为高频考点,侧重于学生的分析能力的考查,注意溶液中Kw的应用,影响因素的分析等,属于基础知识的考查,题目难度不大.

练习册系列答案
 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案
相关题目
13.下列各种醇不能被氧化的是( )
| A. | CH3OH | B. |  | C. |  | D. |  |
14.一定量的盐酸与过量的铁粉反应时,为了减缓反应速率且不影响生成氢气的总量,可向盐酸中加入适量的( )
①NaOH固体;②Na2SO4溶液;③KNO3溶液;④H2O;⑤CaCO3固体;⑥NaCl固体.
①NaOH固体;②Na2SO4溶液;③KNO3溶液;④H2O;⑤CaCO3固体;⑥NaCl固体.
| A. | ①②⑤ | B. | ②③⑥ | C. | ②③④⑤ | D. | ②④ |
11.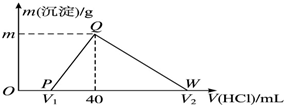 常温下,将一定量的钠铝合金置于水中,合金全部溶解,得到20mL pH=14的溶液,然后用1mol•L-1的盐酸滴定,测得生成沉淀的质量与消耗盐酸的体积关系如图所示,则下列说法不正确的是( )
常温下,将一定量的钠铝合金置于水中,合金全部溶解,得到20mL pH=14的溶液,然后用1mol•L-1的盐酸滴定,测得生成沉淀的质量与消耗盐酸的体积关系如图所示,则下列说法不正确的是( )
 常温下,将一定量的钠铝合金置于水中,合金全部溶解,得到20mL pH=14的溶液,然后用1mol•L-1的盐酸滴定,测得生成沉淀的质量与消耗盐酸的体积关系如图所示,则下列说法不正确的是( )
常温下,将一定量的钠铝合金置于水中,合金全部溶解,得到20mL pH=14的溶液,然后用1mol•L-1的盐酸滴定,测得生成沉淀的质量与消耗盐酸的体积关系如图所示,则下列说法不正确的是( )| A. | OP段发生的反应为:OH-+H+═H2O | B. | 图中V2为100 | ||
| C. | 沉淀的质量m为1.56 g | D. | 原合金质量为0.92 g |
18.下列有关除去杂质的方法中,不正确的是(括号中的物质为杂质)( )
| A. | 苯(苯酚):加浓溴水,过滤 | |
| B. | 淀粉溶液(NaCl):半透膜,渗析 | |
| C. | 溴乙烷(乙醇):加蒸馏水,分液 | |
| D. | 乙酸乙酯(乙醇):加饱和碳酸钠溶液,分液 |
8.由2-氯丙烷制取少量的1,2-二氯丙烷时,需要经过下列哪几步反应( )
| A. | 加成→消去 | B. | 加成→水解 | C. | 消去→加成 | D. | 消去→取代 |
15. 下列①②对应的试剂(或条件)不能完成实验目的是( )
下列①②对应的试剂(或条件)不能完成实验目的是( )
 下列①②对应的试剂(或条件)不能完成实验目的是( )
下列①②对应的试剂(或条件)不能完成实验目的是( )| 实验目的 | 试剂(或条件) | |
| A | 用稀硫酸比较铝和铁的金属活动性 | ①铝粉 ②铁钉 |
| B | 温度对H2O2分解反应速率的影响 | ①热水浴②冰水浴 |
| C | 用Na块检验乙醇分子存在不同于烃分子里的氢原子 | ①乙醇 ②煤油 |
| D | 用酸化的AgNO3溶液检验海水中Cl-能否蒸馏除去 | ①海水 ②蒸馏所得液体 |
| A. | A | B. | B | C. | C | D. | D |
13.下列说法正确的是( )
| A. | Na2O2、NaClO中所含化学键类型完全相同 | |
| B. | 只有活泼金属与活泼非金属元素之间才能形成离子键 | |
| C. | D2O和T2O是同一物质 | |
| D. | 氯气与NaOH反应的过程中,同时又离子键、极性键和非极性键的断裂和形成 |