题目内容
【题目】下列事实能用勒夏特列原理解释的是( )
A. 紫色石蕊试液遇酸变为红色
B. 使用铁触媒,可加快合成氨反应速率
C. 合成氨工业采用500℃的高温进行生产
D. 一定条件下2HI(g) ![]() H2(g)+I2(g)达平衡后,压缩体系的容器,颜色迅速变深
H2(g)+I2(g)达平衡后,压缩体系的容器,颜色迅速变深
【答案】A
【解析】A、石蕊是有机弱酸,存在电离平衡,加入酸,增加c(H+),平衡向逆反应方向移动,符合勒夏特列原理,故A正确;B、铁触媒是催化剂,催化剂对化学平衡移动无影响,因此不符合勒夏特列原理,故B错误;C、合成氨是放热反应,升高温度,平衡向逆反应方向进行,NH3的产量降低,不符合勒夏特列原理,500℃是催化剂的催化效率最高的温度,故C错误;D、反应前后气体系数之和相等,改变压强,平衡不移动,之所以增大压强,颜色加深,是因为容器的体积减小,组分的浓度增大,不符合勒夏特列原理,故D错误。

 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案【题目】(一)雾霾天气肆虐给人类健康带来了严重影响.燃煤和汽车尾气是造成空气污染的原因之一.
(1)汽车尾气净化的主要原理为:2NO(g)+2CO![]() 2CO2(g)+N2(g)△H<O
2CO2(g)+N2(g)△H<O
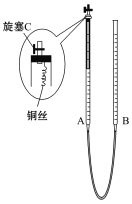
①反应的速率-时间图像如图甲所示.若其他条件不变,仅在反应前加入合适的催化剂,其速率时间图象如图乙所示.以下说法正确的是___________(填对应字母).
![]()

A.a1>a2 B.b1<b2 C.t1>t2
D.图乙中阴影部分面积更大 E.图甲中阴影部分面积更大
②若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是_________(填代号)

(2)直接排放煤燃烧产生的烟气会引起严重的环境问题.煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOx可以消除氮氧化物的污染.
已知:CH4(g)+2NO2(g)![]() N2(g)+CO2(g)+2H2O(g)△H=﹣867kJ/mol
N2(g)+CO2(g)+2H2O(g)△H=﹣867kJ/mol
2NO2(g)![]() N2O4(g)△H=﹣56.9kJ/mol H2O(g)=H2O(l)△H=﹣44.0kJ/mol
N2O4(g)△H=﹣56.9kJ/mol H2O(g)=H2O(l)△H=﹣44.0kJ/mol
写出CH4催化还原N2O4(g)生成N2和H2O(l)的热化学方程式:______________.
(3)CH4和H2O(g) 在催化剂表面发生反应CH4+H2OCO+3H2,该反应在不同温度下的化学平衡常数如表:
温度/℃ | 800 | 1000 | 1200 | 1400 |
平衡常数 | 0.45 | 1.92 | 276.5 | 1771.5 |
①该反应是_________反应(填“吸热”或“放热”).
②T℃时,向1L密闭容器中投入l mol CH4和l mol H2O(g),平衡时c(CH4)=0.5mol/L,该温度下反应CH4+H2O![]() CO+3H2的平衡常数K=______________.
CO+3H2的平衡常数K=______________.
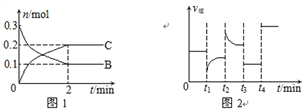
(二)恒温时,将2molA和2molB气体投入固定容积为2L密闭容器中发生反应:2A(g)+B(g) ![]() xC(g)+D(s),10s时,测得A的物质的量为1.7mol,C的反应速率为0.0225mol·L—1·s—1;40s时反应恰好处于平衡状态,此时B的转化率为20%。请填写下列空白:
xC(g)+D(s),10s时,测得A的物质的量为1.7mol,C的反应速率为0.0225mol·L—1·s—1;40s时反应恰好处于平衡状态,此时B的转化率为20%。请填写下列空白:
(1)x=____________
(2)从反应开始到10s,B的平均反应速率为____________
(3)从反应开始到40s达平衡状态,A的平均反应速率为____________
(4)平衡时容器中B的体积分数为____________
(5)下列各项能表示该反应达到平衡状态是____________
A.消耗A的物质的量与生成D的物质的量之比为2∶1
B.容器中A、B的物质的量 n(A)∶n(B) =2∶1
C.气体的平均相对分子质量不再变化
D.压强不再变化
E.气体密度不再变化