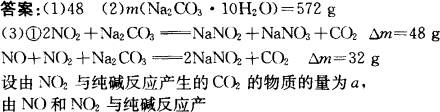
题目内容
硝酸工业生产中的尾气可用纯碱溶液吸收,有关的化学反应为:
2NO2+Na2CO3![]() NaNO2+NaNO3+CO2 ①
NaNO2+NaNO3+CO2 ①
NO+NO2+Na2CO3![]() 2NaNO2+CO2 ②
2NaNO2+CO2 ②
(1)根据反应①,每产生22.4 L(标准状况下)CO2,吸收液质量将增加________g.
(2)配制1 000 g质量分数为21.2%的纯碱吸收液,需Na2CO3·10H2O多少克?
(3)现有1 000 g质量分数为21.2%的纯碱吸收液,吸收硝酸工业尾气,每产生22.4 L(标准状况)CO2时,吸收液质量就增加44 g.
①计算吸收液中NaNO2和NaNO3物质的量之比.
②1 000 g质量分数为21.2%的纯碱吸收液在20℃经充分吸收硝酸工业尾气后,蒸发掉688 g水,冷却到0℃,最多可析出NaNO2多少克?(0℃时,NaNO2的溶解度为71.2g/100 g水).
答案:
解析:
提示:
解析:
|
解析:(1)根据反应方程式①,用差量法很容易求出结果.(2)一定溶质质量分数溶液的配制中计算能力的考查.(3)本问题是问题(1)的延伸,与(1)的不同之处在于CO2来源于①和②两个反应,质量增加也由①和②两个反应引起,只要注意这两点,便可解决问题,详解见答案. |
提示:
|
本题是考生综合计算能力的考查题,既有根据化学方程式的计算内容,又有质量分数和有关溶解度的计算内容;既考查了计算能力,又考查了分析能力,是一个典型的综合计算题. |

练习册系列答案
 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案
相关题目