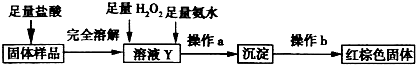
题目内容
在不同温度下,铁粉与水蒸气反应的产物不同.Fe+H2O
| ||
| ||
某兴趣小组用如图所示装置,使铁粉与过量水蒸气充分反应.
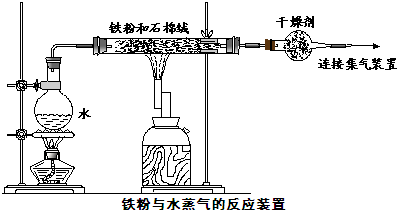
(1)实验过程中,应先点燃
(2)若在实验中的某段时间内生成H2 448mL(已换算成标准状况),则这段时间内参加反应的铁粉质量至少是
(3)铁粉完全反应后,兴趣小组对硬质玻璃管中生成的FeO和Fe3O4的质量进行测定,实验流程如下图(已知石棉绒不溶于盐酸).
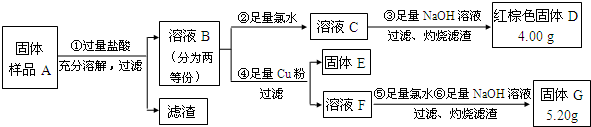
请回答下列问题:
①溶液B中的阳离子有
②固体样品A中铁的氧化物的质量分别是:m(FeO)=
分析:(1)铁能与空气中的氧气发生反应,先加热酒精灯利用生成的水蒸气排除装置中的空气;装置中石棉绒可以增大水蒸气与铁粉的接触面积;
(2)依据3Fe+4H2O(g)
Fe3O4+H2 ,由标准状况下氢气的体积求出氢气的物质的量,依据3Fe+4H2O(g)
Fe3O4+H2 ,求出铁的物质的量,然后计算出铁的质量;
(3)分析流程图注意抓主要阳离子,固体样品A中加入过量盐酸后过滤,滤渣为石棉绒,溶液B含有生成的Fe2+、Fe3+;加氯水把Fe2+氧化为Fe3+,再加氢氧化钠生成氢氧化铁,灼烧得到D氧化铁;若加铜粉,溶液F中含有Fe2+、Cu2+,加氯水把Fe2+氧化为Fe3+,再加氢氧化钠生成氢氧化铁、氢氧化铜沉淀,灼烧得到固体GFe2O3和CuO混合物.
①固体样品A中加入过量盐酸后过滤,滤渣为石棉绒,溶液B中的阳离子有FeO和Fe3O4分别与盐酸反应生成的Fe2+、Fe3+,以及过量盐酸中的H+;
②红棕色固体D为Fe2O3,其中Fe来源于FeO和Fe3O4,固体G为Fe2O3和CuO混合物,质量差1.2g为CuO的质量,由此可求出Fe3+和Fe2+、Cu2+的物质的量,根据Fe3+和Fe2+的物质的量求出FeO和Fe3O4的物质的量,最后换算成质量即可.
(2)依据3Fe+4H2O(g)
| ||
| ||
(3)分析流程图注意抓主要阳离子,固体样品A中加入过量盐酸后过滤,滤渣为石棉绒,溶液B含有生成的Fe2+、Fe3+;加氯水把Fe2+氧化为Fe3+,再加氢氧化钠生成氢氧化铁,灼烧得到D氧化铁;若加铜粉,溶液F中含有Fe2+、Cu2+,加氯水把Fe2+氧化为Fe3+,再加氢氧化钠生成氢氧化铁、氢氧化铜沉淀,灼烧得到固体GFe2O3和CuO混合物.
①固体样品A中加入过量盐酸后过滤,滤渣为石棉绒,溶液B中的阳离子有FeO和Fe3O4分别与盐酸反应生成的Fe2+、Fe3+,以及过量盐酸中的H+;
②红棕色固体D为Fe2O3,其中Fe来源于FeO和Fe3O4,固体G为Fe2O3和CuO混合物,质量差1.2g为CuO的质量,由此可求出Fe3+和Fe2+、Cu2+的物质的量,根据Fe3+和Fe2+的物质的量求出FeO和Fe3O4的物质的量,最后换算成质量即可.
解答:解:(1)铁能与空气中的氧气发生反应,因此为了排除氧气的干扰,先加热酒精灯利用生成的水蒸气排除装置中的空气;装置中石棉绒可以增大水蒸气与铁粉的接触面积,
故答案为:酒精灯;增大铁粉与水蒸气的接触面积;
(2)生成氢气的物质的量n(H2)=
=0.02mol,依据3Fe+4H2O(g)
Fe3O4+4H2可知:n(Fe)=
×n(H2)=
×0.02mol=0.015mol,Fe的质量m(Fe)=0.015mol×56g/mol=0.84g,
故答案为:0.84;
(3)由流程图可知,固体样品A中加入过量盐酸后过滤,滤渣为石棉绒,溶液B含有生成的Fe2+、Fe3+;加氯水把Fe2+氧化为Fe3+,再加氢氧化钠生成氢氧化铁,灼烧得到D氧化铁;若加铜粉,溶液F中含有Fe2+、Cu2+,加氯水把Fe2+氧化为Fe3+,再加氢氧化钠生成氢氧化铁、氢氧化铜沉淀,灼烧得到固体GFe2O3和CuO混合物.
①固体样品A中加入过量盐酸后过滤,滤渣为石棉绒,溶液B中的阳离子有FeO和Fe3O4分别与盐酸反应生成的Fe2+、Fe3+,以及过量盐酸中的H+,
故答案为:Fe3+、Fe2+、H+;
②红棕色固体D为Fe2O3,其物质的量n(Fe2O3)=
=0.025mol,由此可知FeO和Fe3O4中n(Fe2+)+n(Fe3+)=2n(Fe2O3)=0.05mol,固体G为Fe2O3和CuO混合物,则CuO的质量m(CuO)=5.2g-4.0g=1.2g,n(CuO)=
=0.015mol,根据2Fe3++Cu=Cu2++2Fe2+,n(Fe3+)=0.015mol×2=0.03mol,则n(Fe2+)=0.05mol-0.03mol=0.02mol,设FeO的物质的量为xmol,Fe3O4的物质的量为ymol,则有:x+y=0.02、2y=0.03,求得x=0.005,y=0.015,因此m(FeO)=0.005mol×80g/mol=0.4g,m(Fe3O4)=0.015mol×232g/mol=3.48g,
故答案为:0.4;3.48.
故答案为:酒精灯;增大铁粉与水蒸气的接触面积;
(2)生成氢气的物质的量n(H2)=
| 0.448L |
| 22.4L/mol |
| ||
| 3 |
| 4 |
| 3 |
| 4 |
故答案为:0.84;
(3)由流程图可知,固体样品A中加入过量盐酸后过滤,滤渣为石棉绒,溶液B含有生成的Fe2+、Fe3+;加氯水把Fe2+氧化为Fe3+,再加氢氧化钠生成氢氧化铁,灼烧得到D氧化铁;若加铜粉,溶液F中含有Fe2+、Cu2+,加氯水把Fe2+氧化为Fe3+,再加氢氧化钠生成氢氧化铁、氢氧化铜沉淀,灼烧得到固体GFe2O3和CuO混合物.
①固体样品A中加入过量盐酸后过滤,滤渣为石棉绒,溶液B中的阳离子有FeO和Fe3O4分别与盐酸反应生成的Fe2+、Fe3+,以及过量盐酸中的H+,
故答案为:Fe3+、Fe2+、H+;
②红棕色固体D为Fe2O3,其物质的量n(Fe2O3)=
| 4.0g |
| 160g/mol |
| 1.2g |
| 80g/mol |
故答案为:0.4;3.48.
点评:本题考查铁与水蒸气的反应,侧重于化学反应原理和化学计算的综合应用,其中(3)②是难点,在计算中注意抓住主要离子,运用元素守恒进行物质的量的求算.

练习册系列答案
相关题目
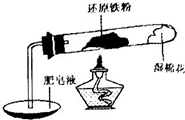 铁不能与冷、热水反应,但能与水蒸气反应.中学教材中用下图所示实验装置,完成还原铁粉与水蒸气反应的演示实验.
铁不能与冷、热水反应,但能与水蒸气反应.中学教材中用下图所示实验装置,完成还原铁粉与水蒸气反应的演示实验.资料显示,在不同温度下,还原铁粉与水蒸气反应的产物是不同的,温度低于570℃时,生成FeO;高于570℃时,生成Fe3O4.
(1)实验中使用肥皂液的作用是
(2)甲同学对实验后试管内的黑色固体X含有哪些物质进行了探究.
提出假设:①所得固体是FeO
②所得固体是Fe3O4
③所得固体是
实验探究:
| 实验编号 | 实验操作 | 实验现象 |
| ① | 取少量黑色粉末X放入试管1中,加入盐酸,微热. | 黑色粉末逐渐溶解,有少量气泡产生. |
| ② | 取试管1反应后的溶液少许,滴加几滴KSCN溶液,振荡. | 溶液没有出现血红色. |
| ③ | 取试管1反应后的溶液少许,滴加几滴酸性KMnO4溶液,振荡 | 高锰酸钾溶液褪色 |
(3)乙同学设计下列实验方案以确定实验后试管内的固体是否存在Fe3O4.
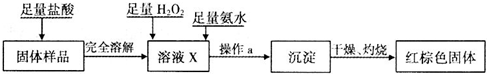
①溶液X中发生氧化还原反应的离子方程式为
②操作a包括过滤和洗涤,检验沉淀是否已经洗涤干净的操作是
③如果取固体样品m1克,反应后得到红棕色固体m2克,则m1与m2之比最少应大于
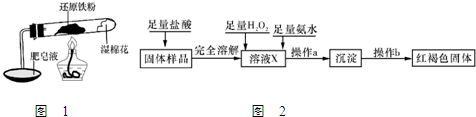
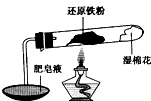 在高温条件下铁与水能发生反应.资料显示,在不同温度下,还原铁粉与水蒸气反应的产物是不同的,温度低于570℃时,生成Fe0,高于570℃时,生成Fe304.老师用如图所示实验装置,完成还原铁粉与水蒸气反应的演示实验.
在高温条件下铁与水能发生反应.资料显示,在不同温度下,还原铁粉与水蒸气反应的产物是不同的,温度低于570℃时,生成Fe0,高于570℃时,生成Fe304.老师用如图所示实验装置,完成还原铁粉与水蒸气反应的演示实验.