题目内容
【题目】下表为元素周期表的一部分, 表中列出10种元素在周期表中的位置,按要求回答下列各题。
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | ⑧ | ⑩ | ||||||
3 | ① | ③ | ⑤ | ⑥ | ⑦ | ⑨ | ||
4 | ② | ④ |
(1)写出下列序号所代表的元素符号③_____;⑩______
(2)写出⑥的一种用途_________________;常温下可与表中_______单质反应(填化学式
(3)元素④的原子结构示意图为________________________;
(4)⑤和⑨形成的化合物的化学式为:_____________;向该化合物的水溶液里逐滴滴入苛性钠溶液,现象为__________________________________________________.
(5)②⑤⑦⑧的原子半径由大到小的顺序是__________________________(用元素符号表示)
(6)将①⑤同时投入到水中,发生反应的化学方程式有:______________
【答案】Mg Ne 半导体等 F2 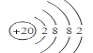 AlCl3 先有白色沉淀产生,而后沉淀溶解 K > Al > P> F 2Na + 2H2O = 2NaOH + H2 ↑、2Al + 2NaOH +6H2O = 2 Na[Al(OH)4] +3 H2 ↑
AlCl3 先有白色沉淀产生,而后沉淀溶解 K > Al > P> F 2Na + 2H2O = 2NaOH + H2 ↑、2Al + 2NaOH +6H2O = 2 Na[Al(OH)4] +3 H2 ↑
【解析】
由元素在周期表中位置,可知①为Na、②为K、③为Mg、④为Ca、⑤为Al、⑥为Si、⑦为P、⑧为F、⑨为Cl、⑩为Ne。
(1)根据元素在周期表中的位置,③是Mg;⑩是Ne;
(2)⑥是Si元素,是常用的半导体材料;常温下单质Si可与F2反应生成SiF4;
(3)元素④是Ca,Ca有4个电子层,最外层电子数为2,原子结构示意图为 ;
;
(4)⑤是Al、⑨是Cl,形成的化合物的化学式为AlCl3;向AlCl3溶液里逐滴滴入氢氧化钠溶液,先生成氢氧化铝沉淀,后氢氧化铝与氢氧化钠反应生成偏铝酸钠,现象为先有白色沉淀产生,而后沉淀溶解;
(5) 电子层数越多半径越大,电子层数相同时,质子数越多半径越小,所以K、Al、P、F的原子半径由大到小的顺序是K> Al>P>F;
(6) Na、Al同时投入到水中,钠先与水反应生成氢氧化钠和氢气,氢氧化钠再与铝反应生成四羟基合铝酸钠和氢气,发生反应的化学方程式有2Na + 2H2O=2NaOH + H2↑、2Al + 2NaOH +6H2O=2 Na[Al(OH)4] +3H2↑。

 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案【题目】某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响.在常温下按照如下方案完成实验。
实验编号 | 反应物 | 催化剂 |
① | 10mL2% H2O2溶液 | 无 |
② | 10mL5% H2O2溶液 | 无 |
③ | 10mL5% H2O2溶液 | 1mL0.1molL﹣1FeCl3溶液 |
④ | 10mL5% H2O2溶液+少量HCl溶液 | 1mL0.1molL﹣1FeCl3溶液 |
⑤ | 10mL5% H2O2溶液+少量NaOH溶液 | 1mL0.1molL﹣1FeCl3溶液 |
(1)催化剂能加快化学反应速率的原因是___________________________________(用过渡态理论来解释);
(2)常温下5% H2O2溶液的pH约为6,H2O2的电离方程式为_______________________;
(3)实验①和②的目的是_____________________________________________________;实验时由于没有观察到明显现象而无法得出结论.资料显示,通常条件下H2O2稳定,不易分解.为了达到实验目的,你对原实验方案的改进是____________________________________;
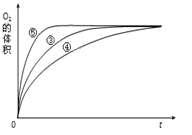
(4)实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如图。 分析图能够得出的实验结论是_________________________________________。
【题目】湿法炼锌产生的铜镉渣主要含锌、铜、铁、镉(Cd)、钴(Co)等单质。一种由铜镉渣生产金属镉的流程如下:

下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为0.1mol/L计算):
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Cd(OH)2 |
开始沉淀的pH | 1.5 | 6.5 | 7.2 |
沉淀完全的pH | 3.3 | 9.9 | 9.5 |
(1)浸出过程中,不采用通入空气的方法进行搅拌,原因是防止将Cu氧化浸出,其离子方程式是__________________。
(2)除钴过程中,锌粉会与As2O3形成微电池产生AsH3。该微电池的正极反应式为_____。
(3)除铁时先加入适量KMnO4,再加入ZnO调节pH。
① 除铁过程中,理论上参加反应的物质n(KMnO4)∶n(Fe2+)=_________。
② 除铁时加入ZnO控制反应液pH的范围为________________。
(4)若上述流程中投入的KMnO4不足量,则待电解溶液中有Fe元素残余。请设计实验方案加以验证:_____________________。
(5)净化后的溶液用惰性电极电解可获得镉单质。电解废液中可循环利用的溶质是_____。