题目内容
根据相关化学原理,下列推断正确的是( )A.若晶体A为原子晶体,晶体B为分子晶体,则熔点:B>A
B.若X原子的质子数为a,中子数为b,则X的质量数为:a-b
C.若R2-离子和M+离子的电子层结构相同,则离子的核电荷数:R2-<M+
D.若弱酸HA的酸性强于弱酸HB,则相同条件下同浓度钠盐溶液的pH:NaA>NaB
【答案】分析:A、根据晶体类型判断熔点高低,一般来说,原子晶体的熔点大于分子晶体的熔点.
B、质量数=质子数+中子数.
C、电子层数相同的离子,阳离子的核电荷数大于阴离子的核电荷数.
D、酸越弱,形成的钠盐碱性越强.
解答:解:A、原子晶体的熔点大于分子晶体的熔点,即熔点:A>B,故A错误.
B、质量数=质子数+中子数=a+b,故B错误.
C、电子层数相同的离子,阳离子的核电荷数大于阴离子的核电荷数,所以离子的核电荷数:R2-<M+,故C正确.
D、酸越弱,形成的钠盐碱性越强,所以弱酸HA的酸性强于弱酸HB,则相同条件下同浓度钠盐溶液的pH:NaB>NaA,故D错误.
故选C.
点评:本题考查了晶体熔沸点的高低的判断、盐酸碱性的判断等知识点,注意电子层结构相同的离子核电荷数的判断方法.
B、质量数=质子数+中子数.
C、电子层数相同的离子,阳离子的核电荷数大于阴离子的核电荷数.
D、酸越弱,形成的钠盐碱性越强.
解答:解:A、原子晶体的熔点大于分子晶体的熔点,即熔点:A>B,故A错误.
B、质量数=质子数+中子数=a+b,故B错误.
C、电子层数相同的离子,阳离子的核电荷数大于阴离子的核电荷数,所以离子的核电荷数:R2-<M+,故C正确.
D、酸越弱,形成的钠盐碱性越强,所以弱酸HA的酸性强于弱酸HB,则相同条件下同浓度钠盐溶液的pH:NaB>NaA,故D错误.
故选C.
点评:本题考查了晶体熔沸点的高低的判断、盐酸碱性的判断等知识点,注意电子层结构相同的离子核电荷数的判断方法.

练习册系列答案
 激活思维优加课堂系列答案
激活思维优加课堂系列答案 活力试卷系列答案
活力试卷系列答案 课课优能力培优100分系列答案
课课优能力培优100分系列答案
相关题目
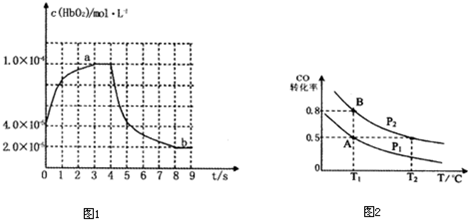
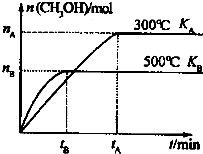 CO和H2与我们的生产和生活等方面密切相关.
CO和H2与我们的生产和生活等方面密切相关.
