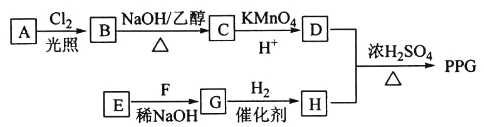
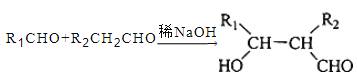题目内容
【题目】I.在空气中泄漏的二氧化硫,会被氧化而形成硫酸雾或硫酸盐气溶胶,污染环境。工业上常用Na2SO3溶液吸收、活性炭还原等方法处理二氧化硫,以减小对空气的污染。
(1)写出用Na2SO3溶液吸收SO2的离子方程式。________________
(2)钠原子核外有________种能量不同的电子。写出硫原子最外层电子的轨道表示式。____________
(3)H2O比H2S稳定,请用分子结构的知识简述其理由。______________________
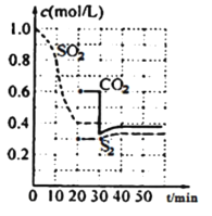
II.一定温度下,固定容积的密闭容器中反生下列反应:2C(s)+2SO2(g) ![]() S2(g)+2CO2(g),反应过程中,各物质浓度与时间的关系如图:
S2(g)+2CO2(g),反应过程中,各物质浓度与时间的关系如图:
(4)该反应平衡常数表达式为K=________
(5)0~20min化学反应速率表示v(SO2)=________;建立平衡过程中,混合气体的密度________(选填“增大”、“减小”或“不变”)简述其原因。___________________________
(6)30min时改变外界条件,使v(正)________v(逆)(选填“大于”、“小于”或“等于”)。
【答案】SO32-+SO2+H2O=2HSO3- 4 ![]() 两种分子结构相似,O原子半径比S小,H-O的键长比H-S短,键能大,因此H2O比H2稳定 K=
两种分子结构相似,O原子半径比S小,H-O的键长比H-S短,键能大,因此H2O比H2稳定 K=![]() 0.03mol/(L·min) 增大 容器体积不变,且混合气体质量增加,故密度增大 大于
0.03mol/(L·min) 增大 容器体积不变,且混合气体质量增加,故密度增大 大于
【解析】
I.(1)正盐+酸=酸式盐,用Na2SO3溶液吸收SO2的离子方程式SO32-+SO2+H2O=2HSO3-;
(2)钠有三个电子层,钠原子核外有1s、2s、2p、3s共4种能量不同的电子。硫原子最外层有6个电子,3S上有两个电子,3P能级上有4个电子,硫原子最外层电子的轨道表示式![]() 。
。
(3)H2O比H2S稳定,用分子结构的知识简述其理由:两种分子结构相似,O原子半径比S小,H-O的键长比H-S短,键能大,因此H2O比H2S稳定;
II.(4)2C(s)+2SO2(g) ![]() S2(g)+2CO2(g),中碳是固体,由平衡常数定义K=
S2(g)+2CO2(g),中碳是固体,由平衡常数定义K=![]() ;
;
(5)0~20min化学反应速率表示v(SO2)=(1.0mol·L-1-0.4mol·L-1)/20min=0.03mol/(L·min);
建立平衡过程中,容器体积不变,且混合气体质量增加,混合气体的密度增大。
(6)30min时改变外界条件,从图中生成物的浓度增大,平衡正向移动,使v(正)大于v(逆)。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】醇脱水是制取烯烃的常用方法,实验室以环己醇为原料制取环己烯的实验装置如图所示。
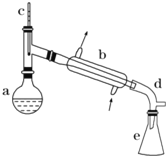
反应的化学方程式:
合成反应: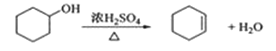
在a中加入40g环己醇和2小片碎瓷片,冷却搅动下慢慢加入1mL浓硫酸,b中通入冷却水后,开始缓慢加热a,控制馏出物的温度不超过90℃。
分离提纯:
反应粗产物倒入分液漏斗中,分别用少量5%碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙,最终通过蒸馏得到纯净环己烯20g。
可能用到的有关数据如下:
相对分子质量 | 密度/(g·cm-3) | 沸点/℃ | 溶解性 | |
环己醇 | 100 | 0.9618 | 161 | 微溶于水 |
环己烯 | 82 | 0.8102 | 83 | 难溶于水 |
回答下列问题:
(1)装置b的名称是___________
(2)加入碎瓷片的作用是_________
(3)本实验中最容易产生的副反应的化学方程式为______________
(4)分离提纯过程中加入无水氯化钙的目的是________________
(5)本实验所得到的环己烯产率是____(填正确答案标号)
A.41% B.50% C.61% D.70%