题目内容
写出下列各粒子的化学式(1)由2个原子构成的具有10个电子的分子有______,阴离子有______.
(2)由4个原子构成的具有10个电子的分子有______,阳离子有______.
(3)由3个原子构成的具有10个电子的分子有______.
(4)由5个原子构成的具有10个电子的阳离子有______.
答案:
解析:
解析:
| 解析(有序思维法):由熟知的Ne原子开始分析.Ne原子具有10个电子,由Ne往前推:F-、O2-、N3-,由Ne往后推:Na+、Mg2+、Al3+,都是10电子粒子;F、O、N、C原子的电子数分别为9、8、7、6,它们与H原子的结合产物HF、H2O、NH3、CH4,都是10电子粒子;H2O、NH3分别结合1个质子(H+),得到H3O+、NH+4,都是10电子粒子;F-、O2-、N3-分别与质子(H+)结合,得到HF、OH-、NH-2,也都是10电子粒子.
答案:(1)HF OH- (2)NH3 H3O+ (3)H2O (4)NH+4
|

练习册系列答案
相关题目
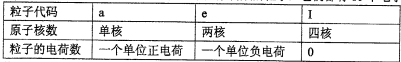
已知a、I、e为三种由短周期元素构成的粒子,它们都有10个电子,其结构特点如下:
|
粒子代码 |
a |
I |
e |
|
原子核数 |
单核 |
四核 |
双核 |
|
粒子的电荷数 |
一个单位正电荷 |
0 |
一个单位负电荷 |
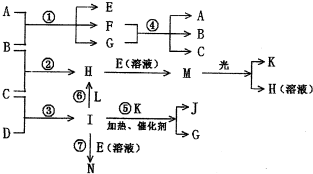
物质A由a、e构成,B、C、D、K都是单质,反应①~⑤都是用于工业生产的反应,各有关物质之间的相互反应转化关系如下图所示:

请填写下列空白:?
(1)写出下列物质的化学式:B J 。
(2)写出下列反应的离子方程式:
①H+E(溶液)→M 。?②I溶于G 。
(3)在通常状况下,若1 g C气体在B气体中燃烧生成H气体时放出92.3 kJ热量,则2 mol H气体完全分解生成C气体和B气体的热化学方程式为 。