题目内容
【题目】硫酸亚铁是一种重要的化工原料,可以制备多种物质。有关下列制备方法错误的是
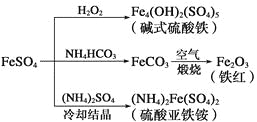
A.制备碱式硫酸铁利用了过氧化氢的氧化性
B.为防止NH4HCO3分解,生产FeCO3需在较低温度下进行
C.可用KSCN溶液检验(NH4)2Fe(SO4)2是否被氧化
D.制备(NH4)2Fe(SO4)2利用了它的溶解度比FeSO4的溶解度大这一性质
【答案】D
【解析】
A.在FeSO4溶液中Fe是+2价,在碱式硫酸铁中Fe是+3价,向FeSO4溶液中加入过氧化氢制备碱式硫酸铁就是利用了过氧化氢的氧化性,正确;
B.NH4HCO3不稳定,受热容易分解,所以为防止NH4HCO3分解,在生产FeCO3需在较低温度下进行,正确;
C.若(NH4)2Fe(SO4)2被氧化,则Fe的化合价由+2价变为+3价,检验Fe3+的方法是利用SCN-与Fe3+结合产生血红色的络合物的现象,正确;
D.向FeSO4溶液中加入(NH4)2SO4晶体,冷却、结晶就可以产生(NH4)2Fe(SO4)2。是因为(NH4)2Fe(SO4)2在水中的溶解度比FeSO4的溶解度小这一性质,错误;
答案选D。

【题目】实验室以苯甲醛为原料制备间溴苯甲醛的反应如下:
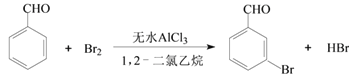
已知:①间溴苯甲醛温度过高时易被氧化。②溴、苯甲醛、1,2-二氯乙烷、间溴苯甲醛的沸点及相对分子质量见下表:
物质 | 溴 | 苯甲醛 | 1,2-二氯乙烷 | 间溴苯甲醛 |
沸点/℃ | 58.8 | 179 | 83.5 | 229 |
相对分子质量 | 160 | 106 | 185 |
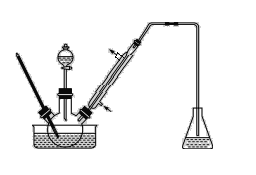
步骤1:将一定配比的无水AlCl3、1,2-二氯乙烷和苯甲醛充分混合后装入三颈烧瓶(如图所示),缓慢滴加经浓硫酸干燥过的足量液溴,控温反应一段时间,冷却。
步骤2:将反应混合物缓慢加入一定量的稀盐酸中,搅拌、静置、分液。有机层用10% NaHCO3溶液洗涤。
步骤3:经洗涤的有机层加入适量无水MgSO4固体,放置一段时间后过滤出MgSO4nH2O晶体。
步骤4:分离有机层,收集相应馏分。
(1)实验装置中盛装液溴的仪器名称是_____,锥形瓶中的试剂为NaOH溶液其作用为________。
(2)步骤1反应过程中,为提高原料利用率,适宜的温度范围为(填序号)___。
A.>229℃ B.58.8℃~179℃ C.<58.8℃
(3)步骤2中用10% NaHCO3溶液洗涤,是为了除去溶于有机层的___(填化学式)。
(4)步骤4中采用何种蒸馏方式_______,其目的是为了防止________。
(5)若实验中加入了5.3 g苯甲醛,得到3.7 g间溴苯甲醛。则间溴苯甲醛产率为______。
【题目】1L某溶液中含有的离子如下表:
离子 |
|
|
|
|
物质的量浓度
| 1 | 1 |
| 1 |
用惰性电极电解该溶液,当电路中有![]() 通过时(忽略电解时溶液体积的变化及电极产物可能存在的溶解现象),下列说法正确的是
通过时(忽略电解时溶液体积的变化及电极产物可能存在的溶解现象),下列说法正确的是
A.电解后混合溶液的pH=0B.a=3
C.阳极生成![]() D.阴极析出的金属是铜与铝
D.阴极析出的金属是铜与铝