题目内容
(11分)已知Ca(OH)2的溶解度随温度升高而降低。如下图所示, 在试管中放入少许镁条,将试管浸入盛饱和石灰水的烧杯中,再向试管中滴入5mL 5mol · L-1盐酸。
(1)实验中可观察到的现象有:
①_____________________ _ ______;
②_____________________________ _____。
(2)试管中发生反应的离子方程式为______________________________。
(3)由实验推知,镁条和盐酸的总能量_________(填“大于”、“小于”或“等于”)MgCl2溶液和H2的总能量。判断的根据是__________ ___________。
(10分)
(1)①镁条上有气泡逸出 ②饱和石灰水变浑浊 (各2分,共4分)
(2)Mg+2H+=Mg2++H2↑ (2分)
(3)大于(2分);因为盐酸与Mg反应是放热反应,故反应物总能量应大于生成物总能量(2分)
解析

练习册系列答案
相关题目
(15分)已知Cr(OH)3在碱性较强的溶液中将生成[Cr(OH)4]―,铬的化合物有毒,由于+6价铬的强氧化性,其毒性是+3价铬毒性的100倍。因此,必须对含铬的废水进行处理,可采用以下还原法,在酸性介质中用FeSO4等将+6价铬还原成+3价铬。
具体流程如下:
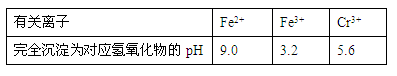
有关离子完全沉淀的pH如下表:
| 有关离子 | Fe2+ | Fe3+ | Cr3+ |
| 完全沉淀为对应氢氧化物的pH | 9.0 | 3.2 | 5.6 |
(2)还原+6价铬还可选用以下的 试剂(填序号)。
A.明矾 B.铁屑 C.生石灰 D.亚硫酸氢钠
(3)在含铬废水中加入FeSO4,再调节pH,使Fe3+和Cr3+产生氢氧化物沉淀。
在操作②中调节pH应分2次进行,第1次应先调节溶液的pH范围约在 (填序号)最佳,第2次应调节溶液的pH范围约在 (填序号)最佳
A.3~4 B.6~8 C.10~11 D.12~14
用于调节溶液的最佳试剂为: (填序号);
A.Na2O2 B.Ba(OH)2 C.Ca(OH)2 D.NaOH