题目内容
已知二氧化硫能与碘水发生反应: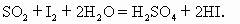 现将一定量的二氧化硫和氮气的混合气体通入含淀粉的0.025mol/L的碘水20mL中,恰好使蓝色褪去时,测得没有反应的气体体积为89.6mL(标准状况).求:
现将一定量的二氧化硫和氮气的混合气体通入含淀粉的0.025mol/L的碘水20mL中,恰好使蓝色褪去时,测得没有反应的气体体积为89.6mL(标准状况).求:
(1)混合气体中氮气的体积分数;
(2)在所得溶液中需加入0.02mol/L的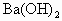 溶液多少毫升,可恰好中和?
溶液多少毫升,可恰好中和?
答案:
解析:
解析:
|
(1)88.9%;(2)50mL |

练习册系列答案
相关题目
题目内容
已知二氧化硫能与碘水发生反应: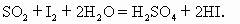 现将一定量的二氧化硫和氮气的混合气体通入含淀粉的0.025mol/L的碘水20mL中,恰好使蓝色褪去时,测得没有反应的气体体积为89.6mL(标准状况).求:
现将一定量的二氧化硫和氮气的混合气体通入含淀粉的0.025mol/L的碘水20mL中,恰好使蓝色褪去时,测得没有反应的气体体积为89.6mL(标准状况).求:
(1)混合气体中氮气的体积分数;
(2)在所得溶液中需加入0.02mol/L的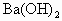 溶液多少毫升,可恰好中和?
溶液多少毫升,可恰好中和?
|
(1)88.9%;(2)50mL |
