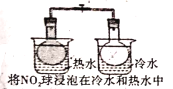
题目内容
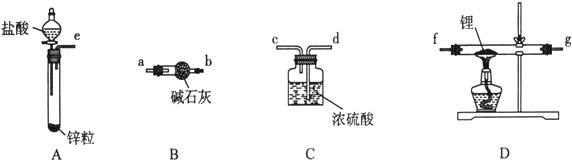
【题目】实验室制取氯气的装置如图:
(1)仪器F的名称是_____________;按图组装好装置后首先要进行的操作是:_________________。
(2)写出E中发生反应的离子方程式:_____________________________________________________。
(3)实验室也可以用浓盐酸与高锰酸钾反应来制取少量的氯气,反应的化学方程式为:2KMnO4+16HCl(浓)=2MnCl2+2KCl+5Cl2↑+8H2O,则该反应的氧化产物是_____________________。
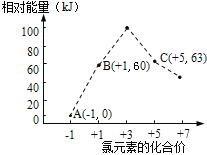
(4)氯元素能形成多种离子。在水溶液中1 mol Cl-、1 molClOx-(x=1,2,3,4)能量的相对大小如图所示,试判断B→A+C反应是___________反应(填“吸热”或“放热”);若有1.5molB发生反应,转移电子的物质的量为___________mol。
【答案】分液漏斗 检查装置气密性 Cl2 + 2OH— = Cl— + ClO— + H2O Cl2 放热 2
【解析】
(1)-(3)制备气体时,安装好装置后,需要检查装置的气密性;实验室用二氧化锰与浓盐酸加热制备氯气中混有氯化氢和水蒸气,可以用饱和食盐水和浓硫酸进行除杂和干燥;氯气有毒,尾气需要碱液吸收处理;也可以用高锰酸钾溶液与浓盐酸反应,高锰酸钾做氧化剂,盐酸做还原剂,氯气为氧化产物,据此进行分析;
(4)由题意确定A、B、C分别为Cl—、ClO—、ClO3—,根据转移电子守恒得离子方程式;根据反应热=反应物总键能-生成物总键能进行计算;根据反应电子转移情况进行相关计算。
(1)仪器F的名称是分液漏斗;组装好装置后首先要进行的操作是检查装置气密性,避免气体泄漏。
(2)E中尾气吸收:Cl2 + 2OH— = Cl— + ClO— + H2O。
(3)发生氧化反应的粒子是Cl-,所得产物就是氧化产物Cl2。
(4)由题意确定A、B、C分别为Cl—、ClO—、ClO3—,根据转移电子守恒得离子方程式: 3ClO—=2Cl—+ClO3—,反应热等于63KJ/mol+2×0KJ/mol—3×60KJ/mol=—117KJ/mol,该反应为放热反应;分析方程式:3mol ClO—转移4mol电子,消耗1.5mol ClO—,转移2mol电子。

【题目】某化学小组用下列装置和试剂进行实验,探究O2与KI溶液发生反应的条件。
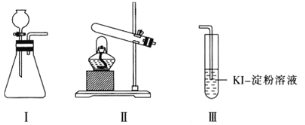
供选试剂:质量分数为30%的H2O2溶液、0.1 mol·L-1的H2SO4溶液、MnO2固体、KMnO4固体。
(1)小组同学设计甲、乙、丙三组实验,记录如下:
操作 | 现象 | |
甲 | 向装置I的锥形瓶中加入MnO2固体,向装置I的____中加入质量分数为30%的H2O2溶液,连接装置I、III,打开活塞 | 装置I中产生无色气体并伴随大量白雾;装置III中有气泡冒出,溶液迅速变蓝 |
乙 | 向装置II中加入KMnO4固体,连接装置II、III,点燃酒精灯 | 装置III中有气泡冒出,溶液不变蓝 |
丙 | 向装置II中加入____,向装置III中再加入适量0.1mol·L-1的H2SO4溶液,连接装置II、III,点燃酒精灯 | 装置III中有气泡冒出,溶液变蓝 |
(2)丙实验中O2与KI溶液反应的离子方程式为___________________________________。
(3)对比乙、丙实验可知,O2与KI溶液发生反应的适宜条件是__________。为进一步探究该条件对反应速率的影响,可采取的实验措施是____________________________。
(4)由甲、乙、丙三组实验推测,甲实验中可能是I中的白雾使溶液变蓝。为了验证推测,可将装置I中产生的气体通入_________(填字母)溶液中,依据实验现象来证明白雾中含有H2O2。
A.酸性KMnO4 B.FeCl2 C.H2S
(5)资料显示:KI溶液在空气中久置的过程中会被缓慢氧化:4KI+O2+2H2O=2I2+4KOH。该小组同学取20 mL久置的KI溶液,向其中加入几滴淀粉溶液,结果没有观察到溶液颜色变蓝,他们猜想可能是发生了反应___________________________________(写离子方程式)造成的,请设计实验证明他们的猜想是否正确:___________________________________。