题目内容
试样x由氧化亚铁和氧化铜组成.取质量相等的两份试样,按下图所示进行实验.

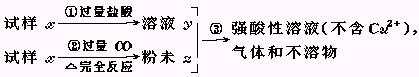
 (1)请写出步骤③中所发生的全部反应的离子方程式.
(1)请写出步骤③中所发生的全部反应的离子方程式.
 (2)若全部的溶液y和全部的粉末Z充分反应后,生成的不溶物的质量是m,则每份试样x中氧化铜的质量为 (用m表示).
(2)若全部的溶液y和全部的粉末Z充分反应后,生成的不溶物的质量是m,则每份试样x中氧化铜的质量为 (用m表示).


 (1)请写出步骤③中所发生的全部反应的离子方程式.
(1)请写出步骤③中所发生的全部反应的离子方程式. (2)若全部的溶液y和全部的粉末Z充分反应后,生成的不溶物的质量是m,则每份试样x中氧化铜的质量为 (用m表示).
(2)若全部的溶液y和全部的粉末Z充分反应后,生成的不溶物的质量是m,则每份试样x中氧化铜的质量为 (用m表示).(1)Fe+Cu2+=Fe2++Cu Fe+2H+=Fe2+H2↑



 (2)
(2)  m
m




 (2)
(2)  m
m 本题第一问比较简单.发生的反应为:Fe+Cu2+=Fe2++Cu,Fe+2H+=Fe2++H2↑
本题第一问比较简单.发生的反应为:Fe+Cu2+=Fe2++Cu,Fe+2H+=Fe2++H2↑ 第二问是考查思维的严密性和敏捷性.由题意,反应后溶液中不含Cu2+,所以两份试样中的铜元素全部转化为单质铜,而溶液是强酸性,则固体物中无Fe,所以m为铜的质量.故一份试样中氧化铜的质量为
第二问是考查思维的严密性和敏捷性.由题意,反应后溶液中不含Cu2+,所以两份试样中的铜元素全部转化为单质铜,而溶液是强酸性,则固体物中无Fe,所以m为铜的质量.故一份试样中氧化铜的质量为 ×MCuO=
×MCuO= m=
m= m.
m.
练习册系列答案
相关题目
 现将有铜的印刷线路板浸入120mLFeCl3的浓溶液中,有9.6gCu被腐蚀掉。取出印刷线路板,向溶液中加入8.4g铁粉,经充分反应,溶液中还存在4.8g不溶物。则:
现将有铜的印刷线路板浸入120mLFeCl3的浓溶液中,有9.6gCu被腐蚀掉。取出印刷线路板,向溶液中加入8.4g铁粉,经充分反应,溶液中还存在4.8g不溶物。则: