题目内容
可逆反应2SO2(g) + O2(g) 2SO3(g) 从正方向开始,并达到了平衡。此时SO2和O2的物质的量之比为
2SO3(g) 从正方向开始,并达到了平衡。此时SO2和O2的物质的量之比为
2∶1;若采取某种措施,导致SO2和O2又消耗了一些,并再次达到平衡,下列说法正确的是
 2SO3(g) 从正方向开始,并达到了平衡。此时SO2和O2的物质的量之比为
2SO3(g) 从正方向开始,并达到了平衡。此时SO2和O2的物质的量之比为2∶1;若采取某种措施,导致SO2和O2又消耗了一些,并再次达到平衡,下列说法正确的是
[ ]
A.若所采取的措施是缩小容器的容积,则新平衡SO2和O2转化率之比和旧平衡中SO2和O2的转化率之比都是1∶1
B.平衡向正反应方向移动了,原因是正反应速率增大了,逆反应速率减小了
C.新平衡体系与旧平衡体系比较,SO3的浓度肯定增大了
D.新平衡体系中,SO2和O2物质的量之比仍为2∶1
B.平衡向正反应方向移动了,原因是正反应速率增大了,逆反应速率减小了
C.新平衡体系与旧平衡体系比较,SO3的浓度肯定增大了
D.新平衡体系中,SO2和O2物质的量之比仍为2∶1
A

练习册系列答案
 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案
相关题目
已知:可逆反应2SO2(g)+O2(g)  2SO3(g) ΔH<0,在一定条件下达到平衡后,改变下列条件一定能使该平衡向正反应方向移动的是( )
2SO3(g) ΔH<0,在一定条件下达到平衡后,改变下列条件一定能使该平衡向正反应方向移动的是( )
| A.升温增压 | B.降温增压 | C.升温减压 | D.降温减压 |
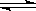 2SO3(g) ,ΔH=
-98.3kJ/mol。下列说法中正确的是( )。
2SO3(g) ,ΔH=
-98.3kJ/mol。下列说法中正确的是( )。 2SO3(g),在已达到平衡后的反应容器中充入少量18O2,一段时间后18O存在于:
2SO3(g),在已达到平衡后的反应容器中充入少量18O2,一段时间后18O存在于: