题目内容
反应2A(g)?2B(g)+C(g)(正反应是放热反应)达到平衡时,要使正反应速率增大,B的浓度减少应采取的措施是( )
| A、减压 | B、减少A的浓度 |
| C、升温 | D、使用催化剂 |
考点:化学平衡的影响因素
专题:化学平衡专题
分析:要使正反应速率增大,可增大反应物浓度、增大压强、升高温度、加入催化剂等,B的浓度减小,可移走B、增大压强或升温,使平衡向逆反应方向移动,以此解答.
解答:
解:A.减压,反应速率减小,故A错误;
B.减小A的浓度,正反应速率减小,故B错误;
C.升高温度,反应速率增大,平衡向逆反应方向移动,B的浓度减小,故C正确;
D.使用催化剂,平衡不移动,B的浓度不变,故D错误.
故选C.
B.减小A的浓度,正反应速率减小,故B错误;
C.升高温度,反应速率增大,平衡向逆反应方向移动,B的浓度减小,故C正确;
D.使用催化剂,平衡不移动,B的浓度不变,故D错误.
故选C.
点评:本题考查外界条件对化学平衡的影响,为高频考点,侧重于学生的分析能力能力的考查,难度不大,本题注意根据反应方程式的特征判断平衡移动的方向.

练习册系列答案
相关题目
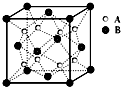 有关资料报道:在40GPa高压下,用激光器加热到1800K,制得了与二氧化硅类似,高熔点、高硬度的二氧化碳晶体,下列关于该晶体的说法不正确的是( )
有关资料报道:在40GPa高压下,用激光器加热到1800K,制得了与二氧化硅类似,高熔点、高硬度的二氧化碳晶体,下列关于该晶体的说法不正确的是( )| A、该晶体属于原子晶体 |
| B、该晶体中碳氧键的键角可为109°28’ |
| C、该晶体中碳、氧原子的最外层都是8个电子 |
| D、每摩原子晶体干冰中含2mol C-O键 |
某学生用天平称量固体时样品和砝码错放位置,待天平平衡时,称得样品质量为10.5克(1克以下用游码),如按正确称法,此样品质量应为( )
| A、10.5克 | B、10.0克 |
| C、9.5克 | D、11.0克 |
在pH=1和pH=14的无色溶液中,都能大量共存的离子组是( )
| A、Cu2+、Cl-、Mg2+、NO3- |
| B、K+、Cl-、Na+、SO42- |
| C、SO32-、Na+、NO3-、Al3+ |
| D、HCO3-、NH4+、Ag+、NO3- |
在容积相同的A、B两个密闭容器中,分别充入2molSO2和1molO2,使它们在相同温度下发生反应:2SO2+O2?2SO3并达到平衡.在反应过程中,若A容器保持体积不变,B容器保持压强不变,当A中的SO2的转化率为25%时,则B容器中SO2的转化率应是( )
| A、25% | B、大于25% |
| C、小于25% | D、12.5% |
从海水中提取镁,可按如下步骤进行:①把贝壳制成石灰乳;②在引入的海水中加入石灰乳,沉降、过滤、洗涤沉淀物;③将沉淀物与盐酸反应,结晶,过滤、得到含结晶水的晶体;④将得到晶体在一定条件下加热得到无水氯化镁;⑤电解无水氯化镁,得到金属镁.下列说法中错误的是( )
| A、此法的优点之一是原料来源丰富 |
| B、①②③步骤的目的是从海水中提取MgCl2 |
| C、以上提取镁的过程中涉及的反应均不是氧化还原反应 |
| D、以上提取镁的过程中涉及化合、分解和复分解反应 |
下列说法不正确的是( )
| A、金属腐蚀就是金属原子失去电子被氧化的过程 |
| B、钢铁吸氧腐蚀时,正极反应式为:2H2O+O2+4e-=4OH- |
| C、氯碱工业中,阳极发生的反应为:2Cl--2e-=Cl2↑ |
| D、镀锌铁皮的镀层损坏后,铁更容易腐蚀 |
把2.3g金属钠放入到100g水中,完全反应后溶质的质量分数为( )
A、
| ||
B、
| ||
C、
| ||
D、
|