题目内容
【题目】“摩尔盐”1(NH4)2Fe(SO4)26H2O]是分析化学中的重要试剂.已知:摩尔盐隔绝空气加热至500℃时可完全分解.某学习小组欲探究其分解产物.
(1)【提出猜想】小组同学认为分解产物可能有以下几种情况:根据所学知识,可确定不成立(填序号).
A.Fe2O3 、 SO2 、 NH3 、H2O
B.FeO 、 SO3 、NH3 、H2O
C.FeO 、 SO2 、NH3 、 H2O
D.Fe2O3 、SO3 、 SO2 、 NH3 、 H2O
(2)【药品验纯】甲同学提出可以用湿润的红色石蕊试纸、稀盐酸和溶液检验出“摩尔盐”中的三种离子;取一定量的“摩尔盐”配成溶液,取少量溶液置于试管中,向其中滴加(填试剂名称和实验现象),则“摩尔盐”未因氧化而变质.
(3)【实验探究】为检验分解产物,甲同学设计了如下实验装置.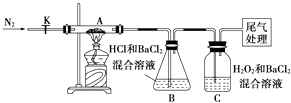
①取一定量“摩尔盐”置于加热管A中,加热至分解完全后打开K,再通入N2 , 目的是 .
②实验中观察到A中固体逐渐变为红棕色,B、C中均产生白色沉淀.C中发生反应的离子方程式为 .
③实验验证:取A中残留物少许加入稀硫酸溶解,再滴入KMnO4稀溶液,不褪色证明产物不含 .
(4)【实验结论与反思】通过实验现象和认真反思,上述(1)猜想中一定正确的是(填序号).
【答案】
(1)C
(2)Ba(OH)2;硫氰化钾溶液,溶液不变红色
(3)使分解产生的气体在B、C中被吸收充分;H2O2+SO2+Ba2+═BaSO4↓+2H+;FeO
(4)D
【解析】解:(1)摩尔盐中N为﹣3价,Fe为+2价,S为+6价,
A.Fe2O3、SO2、NH3、H2O 反应时Fe元素的化合价升高,S元素化合价降低,符合氧化还原反应规律,故A正确;
B.FeO、NH3、SO3、H2O,反应时没有元素化合价的变化,只是发生分解反应,故B正确;
C.FeO、SO2、NH3、H2O反应时只有S元素的化合价降低,不符合氧化还原反应规律,故C错误;
D.Fe2O3、NH3、SO2、SO3、H2O反应时,Fe的化合价升高,S的化合价降低,符合氧化还原反应规律,故D正确,
所以答案是:C;
(2.)摩尔盐中含有的三种离子分别为亚铁离子、硫酸根和铵根,验证铵根需要氢氧根、验证硫酸根需要钡离子,依据所给试剂判断还需要氢氧化钡;亚铁离子若变质应生成铁离子,铁离子遇KSCN变红色,若不变红色,说明未被氧化,
所以答案是:Ba(OH)2;硫氰化钾溶液,溶液不变红色;
(3.)①A中固体充分加热较长时间后,产生气体有一部分残留在装置中,通入氮气可以使分解生成的气体在B、C装置中完全吸收,
所以答案是:使分解产生的气体在B、C中被吸收充分;
②C中有白色沉淀生成,是因为SO2被双氧水氧化成SO42﹣ , SO42﹣再与Ba2+结合成沉淀BaSO4则C中发生的反应为SO2+H2O2+Ba2+=BaSO4↓+2H+ ,
所以答案是:SO2+H2O2+Ba2+=BaSO4↓+2H+;
③实验验证取A中残留物少许加入稀硫酸溶解,再滴入KMnO4稀溶液,不褪色证明产物不含有还原性的物质,即不含有FeO,
所以答案是:FeO;
(4.)根据上述分析知,“摩尔盐”分解的产物为Fe2O3、SO3、SO2、NH3 和H2O,上述猜想中一定正确的是D,故选D,
所以答案是:D.

【题目】为提纯下列物质(括号内物质为杂质),所选用的试剂和分离方法正确的是
物质 | 除杂试剂 | 分离方法 | |
A | 硝酸铜溶液(硝酸银) | 铜粉 | 结晶 |
B | Cl2(HCl) | NaOH溶液 | 洗气 |
C | Br2(H2O) | 酒精 | 萃取 |
D | 铜粉(铁粉) | 稀盐酸 | 过滤 |
A. A B. B C. C D. D