题目内容
10. 元素周期表中第四周期元素由于受3d电子的影响,性质的递变规律与短周期元素略有不同.
元素周期表中第四周期元素由于受3d电子的影响,性质的递变规律与短周期元素略有不同.(1)第四周期过渡元素的明显特征是形成多种多样的配合物.
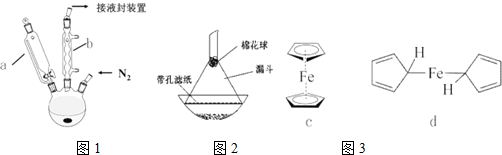
①CO可以和很多过渡金属形成配合物,如羰基铁[Fe(CO)5]、羰基镍[Ni(CO)4].CO分子中C原子上有一对孤对电子,C、O原子都符合8电子稳定结构,CO的结构式为C≡O,与CO互为等电子体的离子为CN-(填化学式).
②金属镍粉在CO气流中轻微加热,生成液态Ni(CO)4分子.423K时,Ni(CO)4分解为Ni和CO,从而制得高纯度的Ni粉.试推测Ni(CO)4易溶于下列bc.
a.水 b.四氯化碳 c.苯 d.硫酸镍溶液
(2)第四周期元素的第一电离能随原子序数的增大,总趋势是逐渐增大的.镓的基态原子的电子排布式是1s22s22p63s23p63d104s24p1,Ga的第一电离能却明显低于Zn,原因是Zn原子的价电子排布式为3d104s2,体系的能量较低,原子较稳定,故Zn的第一电离能大于Ga.
(3)用价层电子对互斥理论预测H2Se和BBr3的立体结构,两个结论都正确的是d.
a.直线形;三角锥形 b.V形;三角锥形 c.直线形;平面三角形 d.V形;平面三角形
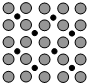
(4)2007年诺贝尔化学奖获得者Gerhard Ertl利用光电子能谱证实:洁净铁(可用于合成氨反应的催化剂)的表面上存在氮原子,如图为氮原子在铁的晶面上的单层附着局部示意图(图中小黑色球代表氮原子,灰色球代表铁原子).则在图示状况下,铁颗粒表面上$\frac{N}{Fe}$原子数比值的最大值为1:2.
分析 (1)①CO分子中C原子上有一对孤对电子,C、O原子都符合8电子稳定结构,则C、O之间为三键;等电子体中原子数和价电子数都相同;
②根据相似相溶原理分析;
(2)根据核外电子排布式的书写规则书写;根据价电子排布判断电离能的大小;
(3)根据价层电子对互斥理论来判断;
(4)根据氮原子在铁的晶面上的单层附着局部示意图可以看出,每个铁原子周围有2个氮原子,而每个氮原子周围有4个铁原子,据此答题.
解答 解:(1)①CO分子中C原子上有一对孤对电子,C、O原子都符合8电子稳定结构,则CO的结构式为C≡O,等电子体中原子数和价电子数都相同,则 N2、CN-、CO的原子数都是2,价电子数都是10,则互为等电子体,
故答案为:C≡O;CN-;
②Ni(CO)4中Ni采取SP3杂化,是正四面体结构,所以属于非极性分子,根据相似相溶原理,非极性溶质易溶于非极性溶剂,苯和四氯化碳是非极性分子,所以Ni(CO)4易溶于苯和四氯化碳,
故答案为:bc;
(2)镓是31号元素,该原子核外有31个电子,4S能级能量小于3d能级能量,根据能量最低原理,电子先排4s能级后排3d能级,所以铜的核外电子排布式为1s22s22p63s23p63d104s24p1;Zn原子的价电子排布式为3d104s2,价电子中3d、4s轨道为全充满状态,原子较稳定,故Zn的第一电离能大于Ga,
故答案为:1s22s22p63s23p63d104s24p1;Zn原子的价电子排布式为3d104s2,体系的能量较低,原子较稳定,故Zn的第一电离能大于Ga;
(3)H2S分子的中心原子S原子上含有2个σ 键,中心原子上的孤电子对数=$\frac{6+1×2}{2}$=4,所以硫化氢分子的VSEPR模型是四面体型,略去孤电子对后,实际上其空间构型是V型;
BF3分子的中心原子B原子上含有3个σ 键,中心原子上的孤电子对数=$\frac{3+1×3}{2}$=3,所以BF3分子的VSEPR模型是平面三角型,中心原子上没有孤对电子,所以其空间构型就是平面三角形.
故选:d;
(4)根据氮原子在铁的晶面上的单层附着局部示意图可以看出,每个铁原子周围有2个氮原子,而每个氮原子周围有4个铁原子,所以对于某个氮原子来讲,属于这个氮原子的铁原子数为4×$\frac{1}{2}$=2,所以氮原子与铁原子的个数比为1:2,
故答案为:1:2.
点评 本题考查物质的结构与性质,注重对电子排布式、等电子体、电离能、价层电子对互斥理论等考点的训练,难度中等.

 计算高手系列答案
计算高手系列答案| A. | 医用酒精 | B. | 蒸馏水 | C. | 漂白粉 | D. | 空气 |
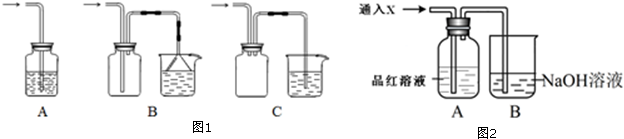
| A. | 通入溴水溶液使溴水褪色 | B. | 通入品红溶液中,使品红褪色 | ||
| C. | 溶于水形成不稳定的亚硫酸 | D. | 与碱液反应生成亚硫酸盐 |
| A. | Cl2能与H2S反应生成S | |
| B. | 溶于水时HCl是强酸,H2S是弱酸 | |
| C. | 受热时H2S能分解,HCl则不能 | |
| D. | Cl2与铁反应生成FeCl3,而S与铁反应生成FeS |
| A. | 植物油不能使溴的四氯化碳溶液褪色( ) | |
| B. | 甲烷和氯气反应生成一氯甲烷与苯和硝酸反应生成硝基苯的反应类型不同 | |
| C. | 乙醇、乙酸和乙酸乙酯能用饱和Na2CO3溶液鉴别 | |
| D. | 苯不能使KMnO4溶液褪色,因此苯不能发生氧化反应 |
| A. | 用氨水吸收过量的SO2:2NH3•H2O+SO2=2NH4++SO32-+H2O | |
| B. | Ca(HCO3)2 溶液中加入少量澄清石灰水:HCO3-+Ca2++OH-=CaCO3↓+H2O | |
| C. | FeI2溶液中通入少量Cl2:2Fe2++Cl2=2Fe3++2Cl- | |
| D. | NaClO溶液和FeCl2溶液混合:2ClO-+Fe2++2H2O=Fe(OH)2↓+2HClO |
| A. | O2、O3互为同位素 | |
| B. | 1H、2H、3H、H+、H2是氢元素形成的五种不同粒子 | |
| C. | 正丁烷和异丁烷互为同素异形体 | |
| D. | 金刚石、C60互为同分异构体 |