题目内容
4.A、B、C、D均为短周期元素.B、A可形成两种液态化合物,其原子个数比分别为:1:1和2:1,且分子中电子总数分别为18和10;B与D能形成一种极易溶于水的碱性气体X,B与C能形成极易溶于水的酸性气体Y.X分子与B2A分子中的电子数相同、Y分子中的电子数为18,A、B、D形成离子化合物,其化学式为B4A3D2,其水溶液呈弱酸性;请回答:(1)元素符号AO、BH、CCl、DN;
(2)B2A2分解的氧化产物是O2(写化学式).
(3)C2和X(过量)反应化学方程式为8NH3+3Cl2=N2+6NH4Cl,每生成1mol单质,转移的电子数为6mol.
(4)B4A3D2的化学式为NH4NO3,其水溶液呈酸性的离子方程式为NH4++H2O?NH3•H2O+H+;
(5)液态X能电离(可根据B2A电离推知),其阴离子电子式为
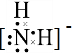 .
.
分析 A、B、C、D均为短周期元素,由B、A可形成两种液态化合物,其原子个数比分别为1:1和2:1,且分子中电子总数分别为18和10,则A为O元素,B为H元素,两种化合物为H2O2、H2O;由B与D可形成一种极易溶于水的碱性气体X,中学阶段碱性气体只有氨气,可知D为N元素,X为NH3;A、B、D可组成离子化合物,该晶体化学式为B4A3D2,其水溶液呈弱酸性,为NH4NO3;B与C能形成极易溶于水的酸性气体Y,Y分子中的电子数为18,故Y为HCl,C为Cl元素,据此解答.
解答 解:A、B、C、D均为短周期元素,由B、A可形成两种液态化合物,其原子个数比分别为1:1和2:1,且分子中电子总数分别为18和10,则A为O元素,B为H元素,两种化合物为H2O2、H2O;由B与D可形成一种极易溶于水的碱性气体X,中学阶段碱性气体只有氨气,可知D为N元素,X为NH3;A、B、D可组成离子化合物,该晶体化学式为B4A3D2,其水溶液呈弱酸性,为NH4NO3;B与C能形成极易溶于水的酸性气体Y,Y分子中的电子数为18,故Y为HCl,C为Cl元素.
(1)由上述分析可知,A为O元素、B为H元素、C为Cl元素、D为N元素,故答案为:O;H;Cl;N;
(2)H2O2分解生成H2O、O2,氧化产物是O2,故答案为:O2;
(3)Cl2和NH3(过量)反应化学方程式为8NH3+3Cl2=N2+6NH4Cl,由N元素化合价变化可知,每生成1mol单质转移的电子数为 1mol×6=6mol,故答案为:8NH3+3Cl2=N2+6NH4Cl;6;
(4)B4A3D2的化学式为NH4NO3,其溶液中NH4+水解NH4++H2O?NH3•H2O+H+,使溶液呈酸性,故答案为:NH4NO3;NH4++H2O?NH3•H2O+H+;
(5)液态NH3与H2O相似,也可以发生微弱的电离,电离出含有相同电子数的微粒为NH4+、NH2-,则NH2-的电子式为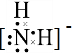 ,故答案为:
,故答案为: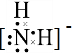 .
.
点评 本题考查元素化合物推断,难度不大,掌握物质的性质推断元素与物质是关键,注意基础知识的掌握.

 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案| A. | +6 | B. | +5 | C. | +4 | D. | +3 |
| A. | 甲、乙中都是铝过量 | B. | 甲中铝过量,乙中碱过量 | ||
| C. | 甲中酸过量,乙中铝过量 | D. | 甲、乙中都是铝不足 |
| A. | Na2C03 | B. | HCl | C. | Na2S04 | D. | KN03 |
| A. | NaCl溶液中离子的总浓度和NaClO溶液中离子的总浓度相等 | |
| B. | NaCl溶液中离子的总浓度大于NaClO溶液中离子的总浓度 | |
| C. | NaCl溶液中离子的总浓度小于NaClO溶液中离子的总浓度 | |
| D. | NaCl溶液的pH大于NaClO溶液的pH |

 .
.  ;
; l,2二溴乙烷可作汽油抗爆剂的添加剂,常温下它是无色液体,密度2.189cm-3,沸点131.4℃,熔点9.79℃,不溶于水,易溶于醇、醚、丙酮等有机溶剂.在实验室中可用下列反应制备1,2二溴乙烷.
l,2二溴乙烷可作汽油抗爆剂的添加剂,常温下它是无色液体,密度2.189cm-3,沸点131.4℃,熔点9.79℃,不溶于水,易溶于醇、醚、丙酮等有机溶剂.在实验室中可用下列反应制备1,2二溴乙烷.