题目内容
某氯化铁样品含有少量FeCl2杂质.现要测定其中铁元素的质量分数,实验按以下步骤进行:
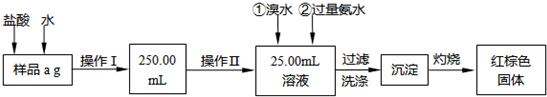
请根据以上流程,回答下列问题:
(1)操作Ⅰ所用到的玻璃仪器除烧杯、玻璃棒外,还必须有______、______(填仪器名称),操作Ⅱ必须用到的仪器是______(填编号).
A.50mL烧杯
B.20mL量筒
C.50mL量筒
D.25mL滴定管
(2)请写出加入溴水发生反应的离子方程式:______.
(3)检验沉淀是否已经洗涤干净的操作是______.
(4)若蒸发皿的质量是W1g,蒸发皿与加热后固体的总质量是W2g,则样品中铁元素的质量分数是______(列出原始算式,不需化简);若称量准确,最终测量的结果偏大,则造成误差的原因可能是______(写出一种原因即可).
解:(1)因配制一定物质的量浓度的溶液所需要的仪器有:量筒、胶头滴管、烧杯、玻璃棒、一定规格的容量瓶;因操作II为滴定操作,必须用滴定管,
故答案:100mL容量瓶;胶头滴管;D;
(2)因Br2具有氧化性,能氧化Fe2+:2Fe2++Br2=2Fe3++2Br-;为了使Fe3+充分沉淀,氨水要过量,形成氢氧化铁沉淀,经灼烧得到氧化铁固体,
故答案为:2Fe2++Br2=2Fe3++2Br-;
(3)溶液中存在溴化铵,可用硝酸酸化的硝酸银溶液检验最后一次洗涤液中是否存在溴离子,以判断沉淀是否洗净,
故答案为:取最后一次洗涤液,于试管中,滴加少量硝酸银溶液,若无黄色沉淀生成,则证明洗涤干净;
(4)因铁元素质量守恒,即红棕色固体中的铁就是样品中铁,Fe2O3的质量为W2-W1g,由于参加反应的溶液只取所配溶液的 ,因此铁元素的质量为5×(W2-W1)g×
,因此铁元素的质量为5×(W2-W1)g×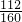 ,样品中铁元素的质量分数是
,样品中铁元素的质量分数是 ×100%;如氢氧化铁为完全分解,计算出铁元素的质量偏高,最终测量的结果偏大,
×100%;如氢氧化铁为完全分解,计算出铁元素的质量偏高,最终测量的结果偏大,
故答案为: ×100%;加热时固体未充分反应变为Fe2O3.
×100%;加热时固体未充分反应变为Fe2O3.
分析:本实验目的是测定铁的质量分数,采取的方法是使样品溶解、反应、最终生成氧化铁,然后通过氧化铁质量来求铁的质量分数.
(1)由图可知,操作I是将加入盐酸反应的溶液稀释成250.00mL溶液,故需要250mL的容量瓶;操作II是准确量取25.00mL的稀释后的溶液,故应需要滴定管;
(2)加溴水目的是让+2价铁变为+3价,加氨水就是使+3价铁充分转化为Fe(OH)3沉淀;
(3)溶液中存在溴化铵,可用硝酸酸化的硝酸银溶液检验最后一次洗涤液中是否存在溴离子;
(4)加热分解所得的物质是Fe2O3,其质量为(W2-W1)g,由于去20mL溶液,故100mL溶液可以得到Fe2O3质量为5(W2-W1)g,根据化学式计算铁元素的质量,再利用质量分数的定义计算原氧化铁样品中铁元素的质量分数.
点评:本题考查溶液配制、离子检验、对实验操作的理解与实验方案的评价、化学计算等,难度中等,清楚测定原理是解题的关键,是对所学知识的综合运用,需要学生具有扎实的基础与运用知识分析解决问题的能力.
故答案:100mL容量瓶;胶头滴管;D;
(2)因Br2具有氧化性,能氧化Fe2+:2Fe2++Br2=2Fe3++2Br-;为了使Fe3+充分沉淀,氨水要过量,形成氢氧化铁沉淀,经灼烧得到氧化铁固体,
故答案为:2Fe2++Br2=2Fe3++2Br-;
(3)溶液中存在溴化铵,可用硝酸酸化的硝酸银溶液检验最后一次洗涤液中是否存在溴离子,以判断沉淀是否洗净,
故答案为:取最后一次洗涤液,于试管中,滴加少量硝酸银溶液,若无黄色沉淀生成,则证明洗涤干净;
(4)因铁元素质量守恒,即红棕色固体中的铁就是样品中铁,Fe2O3的质量为W2-W1g,由于参加反应的溶液只取所配溶液的
 ,因此铁元素的质量为5×(W2-W1)g×
,因此铁元素的质量为5×(W2-W1)g×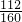 ,样品中铁元素的质量分数是
,样品中铁元素的质量分数是 ×100%;如氢氧化铁为完全分解,计算出铁元素的质量偏高,最终测量的结果偏大,
×100%;如氢氧化铁为完全分解,计算出铁元素的质量偏高,最终测量的结果偏大,故答案为:
 ×100%;加热时固体未充分反应变为Fe2O3.
×100%;加热时固体未充分反应变为Fe2O3.分析:本实验目的是测定铁的质量分数,采取的方法是使样品溶解、反应、最终生成氧化铁,然后通过氧化铁质量来求铁的质量分数.
(1)由图可知,操作I是将加入盐酸反应的溶液稀释成250.00mL溶液,故需要250mL的容量瓶;操作II是准确量取25.00mL的稀释后的溶液,故应需要滴定管;
(2)加溴水目的是让+2价铁变为+3价,加氨水就是使+3价铁充分转化为Fe(OH)3沉淀;
(3)溶液中存在溴化铵,可用硝酸酸化的硝酸银溶液检验最后一次洗涤液中是否存在溴离子;
(4)加热分解所得的物质是Fe2O3,其质量为(W2-W1)g,由于去20mL溶液,故100mL溶液可以得到Fe2O3质量为5(W2-W1)g,根据化学式计算铁元素的质量,再利用质量分数的定义计算原氧化铁样品中铁元素的质量分数.
点评:本题考查溶液配制、离子检验、对实验操作的理解与实验方案的评价、化学计算等,难度中等,清楚测定原理是解题的关键,是对所学知识的综合运用,需要学生具有扎实的基础与运用知识分析解决问题的能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
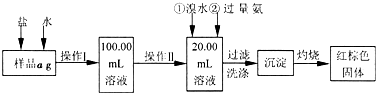
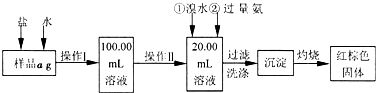
某氯化铁样品含有少量FeCl2杂质。现要测定其中铁元素的质量分数,实验按以下步骤进行:
请根据上面流程,回答以下问题:
(1)操作I所用到的玻璃仪器除烧杯.玻璃棒.量筒外,还必须有____________ (填自选仪器名称),操作II必须用到的仪器是____________(填编号)。
| A.50mL烧杯 | B.50mL量筒 | C.25mL碱式滴定管 | D.25mL酸式滴定管 |
(3)检验沉淀是否已经洗涤干净的操作是________________________。
(4)将沉淀物加热,并置于干燥器中冷却至室温,用天平称量其质量为b1g,再次加热并冷却至室温称量其质量为b2g,若b1-b2=0.3g,则接下来还应进行的操作是____________。
(5)若蒸发皿质量是W1g,蒸发皿与加热后固体总质量是W2g,则样品中铁元素的质量分数是____________。
(6)有同学认为:上述流程中若不加入氯水,其它步骤不变,仍可达到目的。他的理由是________________________。(用化学方程式表示)