题目内容
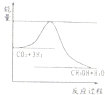
 某恒温密闭容器发生可逆反应Z(?)+W(?)?X(g)+Y(?),在t1时刻反应达到平衡,在t2时刻缩小容器体积,至t3时刻再次达到平衡,反应速率与时间的关系如图.下列有关叙述正确的是( )
某恒温密闭容器发生可逆反应Z(?)+W(?)?X(g)+Y(?),在t1时刻反应达到平衡,在t2时刻缩小容器体积,至t3时刻再次达到平衡,反应速率与时间的关系如图.下列有关叙述正确的是( )| A、Z、W一定不为气体,Y可能为气体,也可能不为气体 | B、t2时刻后该可逆反应向逆反应方向进行,Y的浓度一定减小 | C、在t2时刻加入催化剂,反应速率变化情形与图中t2时刻后类似 | D、若该反应的△H<0,在t2时刻升温,反应速率变化情形与图中t2时刻后类似 |
分析:A、根据增大压强正反应速率不变,可以判断反应物一定不是气体;
B、根据Y的状态分析,若Y为固体或者纯液体,其浓度不变;
C、根据催化剂对对正逆反应速率都有影响,逆反应速率增大,正反应速率一定会增大分析;
D、无论该反应是吸热还是放热,升高温度,正逆反应速率同时增大.
B、根据Y的状态分析,若Y为固体或者纯液体,其浓度不变;
C、根据催化剂对对正逆反应速率都有影响,逆反应速率增大,正反应速率一定会增大分析;
D、无论该反应是吸热还是放热,升高温度,正逆反应速率同时增大.
解答:解:A、在t2时刻缩小容器体积,增大了压强,由图象可知,正反应速率不变,逆反应速率增大,所以反应物Z、W一定不是气体,Y可能为气体,也可能不为气体,故A正确;
B、在t2时刻,逆反应速率大于正反应速率,化学平衡向着逆向移动,若Y为固体或纯液体,Y的浓度不变,故B错误;
C、在t2时刻加入催化剂,由于催化剂对正逆反应速率都有影响,图象中逆反应速率增大,则正反应速率也应该增大,而现在逆反应速率不变,故C错误;
D、无论该反应是吸热反应还是放热反应,温度升高,正逆反应速率一定同时增大;所以在t2时刻升温,反应速率变化情形与图中t2时刻不会类似,故D错误;
故选:A.
B、在t2时刻,逆反应速率大于正反应速率,化学平衡向着逆向移动,若Y为固体或纯液体,Y的浓度不变,故B错误;
C、在t2时刻加入催化剂,由于催化剂对正逆反应速率都有影响,图象中逆反应速率增大,则正反应速率也应该增大,而现在逆反应速率不变,故C错误;
D、无论该反应是吸热反应还是放热反应,温度升高,正逆反应速率一定同时增大;所以在t2时刻升温,反应速率变化情形与图中t2时刻不会类似,故D错误;
故选:A.
点评:本题考查了化学反应速率与化学平衡图象的综合应用,难度中等,需要记住分析影响反应速率因素时,一定不要与化学平衡混淆,例如升高温度,正逆反应速率一定增大,与化学平衡的移动方向无关.

练习册系列答案
 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案
相关题目
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。请回答下列问题:
(1)常温下,某氨水的pH=12,则水电离的c(OH-)= 。若向该氨水中加入等体积、等物质的量浓度的盐酸,此时溶液中水电离的程度 (填“大于”、“等于”或“小于”)氨水中水的电离程度。
(2)合成氨反应N2(g)+3H2(g) 2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,则平衡
移动(填“向左”、“向右”或“不”)。
2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,则平衡
移动(填“向左”、“向右”或“不”)。
(3)一定温度下,在密闭容器中可发生下列反应:2N2O5(g) 4NO2(g)+O2(g)。下表为反应在T1温度下的部分实验数据:
4NO2(g)+O2(g)。下表为反应在T1温度下的部分实验数据:
|
T/s |
0 |
500 |
1000 |
|
c(N2O5)/mol·L-1 |
⑤.00 |
3.50 |
2.42 |
则500s内N2O5的分解速度v(N2O5)=
;降温至T2,反应进行1000s时测得c(NO2)=4.98mol·L-1,则反应N2O5(g) NO2(g)+O2(g)的△H 0。(填“>”、“=”、“<”)。
NO2(g)+O2(g)的△H 0。(填“>”、“=”、“<”)。
(4)最近美国Simons等科学家发明了使NH3直接用于燃料电池的方法,其装置用铂黑作电极、加入电解质溶液中,一个电极通入空气,另一电极通入NH3。其电池反应式为:
4NH3+3O2
2N2+6H2O。你认为电解质溶液应显 (填“酸性”、“中性”或“碱性”),写出正极的电极反应方程式
。
 新型纳米材料氧缺位铁酸盐(ZnFe2Ox),由该铁酸盐(ZnFe2O4)经高温还原制得,常温下,它能使工业废气中酸性氧化物分解除去,转化流程如图所示:
新型纳米材料氧缺位铁酸盐(ZnFe2Ox),由该铁酸盐(ZnFe2O4)经高温还原制得,常温下,它能使工业废气中酸性氧化物分解除去,转化流程如图所示:
 CH3OH(g)+H2O(g) △H3
CH3OH(g)+H2O(g) △H3

