题目内容
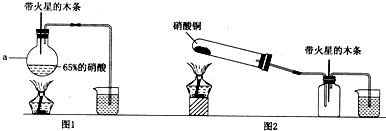
如图是某研究性学习小组设计制取氯气并以氯气为反应物进行特定反应的装置.

(1)要将C装置接入B和D之间,正确韵接法是:a→______→______→d.
(2)实验开始先点燃A处的酒精灯打开阀K,让Cl2充满整个装置,再点燃D处的酒精灯.Cl2通过C装置后进入D装置,D装置内盛有碳粉,发生氧化还原反应,生成CO2和HCl(g),发生反应的化学方程式为______.
(3)D处反应完毕后,关闭阀K,移去两个酒精灯,由于余热的作用,A处仍有少量Cl2产生,此时B中的现象是______,B的作用是______.
(4)在A、B、C、D、E装置中有一处需要改进,说明需要改进的理由并画出改进后的装置图..
解:(1)由装置图判断判断,气体由B流经C进入到D中反应,气体通过盛有水的试管时应长进短出,否则不能通过C装置,故答案为:c,b;
(2)由题意知反应为Cl2、C、H2O,生成物为HCl和CO2,则反应的化学方程式为2Cl2+C+2H2O(g) 4HCl+CO2,C为提供水蒸气的装置;
4HCl+CO2,C为提供水蒸气的装置;
故答案为:2Cl2+C+2H2O(g) 4HCl+CO2;
4HCl+CO2;
(3)关闭旋塞K,移去两个酒精灯,由于余热的作用,A处仍有少量Cl2产生,B中的气体逐渐增多,压强增大,则导致瓶中液面下降,长颈漏斗内液面上升,氯气有毒,不能直接排放到空气中,B具有贮存少量氯气,并能防止空气污染,
故答案为:瓶中液面下降,长颈漏斗内液面上升;贮存少量Cl2,避免Cl2对环境造成污染;
(4)HCl极易溶于水,易产生倒吸现象,应用倒置的漏斗,
故答案为:D中反应生成的HCl气体极易溶于水,易发生倒吸, .
.
分析:(1)气体通过盛有水的试管时应长进短出;
(2)根据反应物和生成物,结合质量守恒定律书写化学方程式;
(3)关闭旋塞K,B中的气体逐渐增多,压强增大,B能贮存气体;
(4)HCl极易溶于水,易产生倒吸现象.
点评:本题考查氯气的制备和性质实验,题目难度中等,注意气密性的检查原理和方法.
(2)由题意知反应为Cl2、C、H2O,生成物为HCl和CO2,则反应的化学方程式为2Cl2+C+2H2O(g)
 4HCl+CO2,C为提供水蒸气的装置;
4HCl+CO2,C为提供水蒸气的装置;故答案为:2Cl2+C+2H2O(g)
 4HCl+CO2;
4HCl+CO2; (3)关闭旋塞K,移去两个酒精灯,由于余热的作用,A处仍有少量Cl2产生,B中的气体逐渐增多,压强增大,则导致瓶中液面下降,长颈漏斗内液面上升,氯气有毒,不能直接排放到空气中,B具有贮存少量氯气,并能防止空气污染,
故答案为:瓶中液面下降,长颈漏斗内液面上升;贮存少量Cl2,避免Cl2对环境造成污染;
(4)HCl极易溶于水,易产生倒吸现象,应用倒置的漏斗,
故答案为:D中反应生成的HCl气体极易溶于水,易发生倒吸,
 .
.分析:(1)气体通过盛有水的试管时应长进短出;
(2)根据反应物和生成物,结合质量守恒定律书写化学方程式;
(3)关闭旋塞K,B中的气体逐渐增多,压强增大,B能贮存气体;
(4)HCl极易溶于水,易产生倒吸现象.
点评:本题考查氯气的制备和性质实验,题目难度中等,注意气密性的检查原理和方法.

练习册系列答案
相关题目
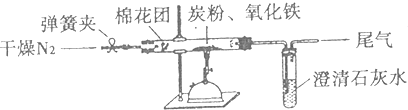


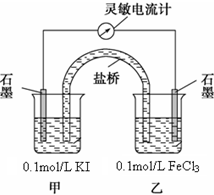 某研究性学习小组为证明2Fe3++2I-?2Fe2++I2为可逆反应(即反应存在一定的限度),设计如下几种方案.已知FeF63-是一种无色的稳定的络离子.
某研究性学习小组为证明2Fe3++2I-?2Fe2++I2为可逆反应(即反应存在一定的限度),设计如下几种方案.已知FeF63-是一种无色的稳定的络离子.