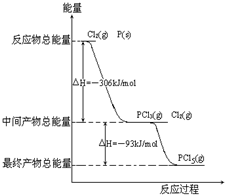
题目内容
(1)铅蓄电池是典型的可充电电池,电池总反应式为:Pb+PbO2+4H++2SO42-
2PbSO4+2H2O.试回答下列问题:
铅蓄电池上有两个接线柱,一个接线柱旁标有“+”,另一个接线柱旁标有“-”,则标有“+”的接线柱在放电时作 极,充电时作 极.
(2)放电时:负极的电极反应式是 ;正极的电极反应式是 ;电解液中H2SO4的浓度将变 ;当外电路通过1mol电子时,理论上负极板的质量增加 g.
| 充电 |
| 放电 |
铅蓄电池上有两个接线柱,一个接线柱旁标有“+”,另一个接线柱旁标有“-”,则标有“+”的接线柱在放电时作
(2)放电时:负极的电极反应式是
考点:常见化学电源的种类及其工作原理
专题:电化学专题
分析:(1)铅蓄电池中,放电时是原电池,Pb元素化合价由0价、+4价变为+2价,所以Pb作负极、PbO2作正极,充电时,Pb电极作阴极、PbO2作阳极;
(2)放电时,负极反应式为Pb-2e-+SO42-=PbSO4,正极反应式为PbO2+2e-+4H++SO42-═PbSO4+2H2O,随着反应的进行,溶液中硫酸浓度减小,根据转移电子与负极质量增加量之间的关系式计算.
(2)放电时,负极反应式为Pb-2e-+SO42-=PbSO4,正极反应式为PbO2+2e-+4H++SO42-═PbSO4+2H2O,随着反应的进行,溶液中硫酸浓度减小,根据转移电子与负极质量增加量之间的关系式计算.
解答:
解:(1)铅蓄电池中,放电时是原电池,Pb元素化合价由0价、+4价变为+2价,所以Pb作负极、PbO2作正极,充电时,Pb电极作阴极、PbO2作阳极,所以则标有“+”的接线柱在放电时作正极,充电时作阳极,
故答案为:正;阳;
(2)放电时,负极反应式为Pb-2e-+SO42-=PbSO4,正极反应式为PbO2+2e-+4H++SO42-═PbSO4+2H2O,随着反应的进行,溶液中硫酸浓度减小,溶液的pH增大,根据Pb-2e-+SO42-=PbSO4知,转移2mol电子时负极质量增加96g,则当外电路通过1mol电子时,理论上负极板的质量增加48g,
故答案为:Pb-2e-+SO42-=PbSO4;PbO2+2e-+4H++SO42-═PbSO4+2H2O;小;48.
故答案为:正;阳;
(2)放电时,负极反应式为Pb-2e-+SO42-=PbSO4,正极反应式为PbO2+2e-+4H++SO42-═PbSO4+2H2O,随着反应的进行,溶液中硫酸浓度减小,溶液的pH增大,根据Pb-2e-+SO42-=PbSO4知,转移2mol电子时负极质量增加96g,则当外电路通过1mol电子时,理论上负极板的质量增加48g,
故答案为:Pb-2e-+SO42-=PbSO4;PbO2+2e-+4H++SO42-═PbSO4+2H2O;小;48.
点评:本题考查原电池和电解池原理,明确各个电极上发生的反应是解本题关键,会正确书写电极反应式,注意充电时连接外接电源正负极的方法,为易错点.

练习册系列答案
 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案
相关题目
在强酸溶液中,下列各组离子能够大量共存的是( )
| A、Mg2+、Ca2+、HCO3-、Cl- |
| B、Na+、AlO2-、Cl-、SO42- |
| C、Cu2+、Fe3+、Br-、MnO4- |
| D、K+、Fe3+、SO42-、NO3- |
32g Cu的物质的量是( )
| A、3.01×1023个 |
| B、0.5mol |
| C、11.2L |
| D、1 mol |
下列叙述正确的是( )
| A、3.01×1023个SO2分子的质量为32 g |
| B、CH4的摩尔质量为16 g |
| C、1 mol H2O的质量为18 g/mol |
| D、不同的气体,若体积不等,则它们所含的分子数一定不等 |
实验中需用2.0mol?L-1的Na2CO3溶液950mL,配制时应选用容量瓶的规格和称取Na2CO3固体的质量分别为( )
| A、100 mL;21.2 g |
| B、500 mL;100.7 g |
| C、1000 mL;201.4 g |
| D、1 000 mL;212.0 g |
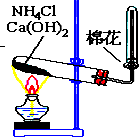 如图所示,是实验室制备某常见气体的实验装置,请填空:
如图所示,是实验室制备某常见气体的实验装置,请填空: