题目内容
3.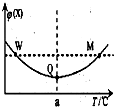 在某恒容密闭容器中充入一定量 X(g)和 Y(g),发生反应2X(g)+Y(g)?3Z(g)△H,反应过程中持续升高温度,测得混合体系中 X 的体积分数与温度的 关系如图.下列推断正确的是( )
在某恒容密闭容器中充入一定量 X(g)和 Y(g),发生反应2X(g)+Y(g)?3Z(g)△H,反应过程中持续升高温度,测得混合体系中 X 的体积分数与温度的 关系如图.下列推断正确的是( )| A. | M 点时,Y 的转化率最大 | |
| B. | 升高温度,平衡常数减小 | |
| C. | 平衡后充入 Z 达到新平衡时 Z 的体积分数增大 | |
| D. | W,M 两点 Y 的正反应速率相等 |
分析 温度在a℃之前,升高温度,X的含量减小,温度在a℃之后,升高温度,X的含量增大,曲线上最低点为平衡点,最低点之前未达平衡,反应向正反应进行,最低点之后,各点为平衡点,升高温度X的含量增大,平衡向逆反应方向移动,故正反应为放热反应,据此分析解答.
解答 解:温度在a℃之前,升高温度,X的含量减小,温度在a℃之后,升高温度,X的含量增大,曲线上最低点为平衡点,最低点之前未达平衡,反应向正反应进行,最低点之后,各点为平衡点,升高温度X的含量增大,平衡向逆反应方向移动,故正反应为放热反应,
A.曲线上最低点Q为平衡点,升高温度平衡向逆反应移动,Y的转化率减小,所以Q点时,Y的转化率最大,M点不是平衡点,故A错误;
B.已知该反应为放热反应,升高温度,平衡逆移,平衡常数减小,故B正确;
C.反应前后气体的物质的量不变,平衡时充入Z,达到平衡时与原平衡是等效平衡,所以达到新平衡时Z的体积分数不变,故C错误;
D.W点对应的温度低于M点对应的温度,温度越高,反应速率越高,所以W点Y的正反应速率小于M点Y的正反应速率,故D错误;
故选B.
点评 本题考查化学平衡图象、化学反应速率和平衡的影响因素、化学平衡常数等,难度中等,判断最低点及之后各点为平衡点是解题的关键.

练习册系列答案
相关题目
13.铁及其化合物在日常生活、生产中应用广泛.研究铁及其化合物的应用意义重大.
I.水体的净化和污水的处理与铁及其化合物密切相关.
(1)自来水厂常用高铁酸钠(Na2FeO4)改善水质.简述高铁酸钠用于杀菌消毒同时又起到净水作用的原理FeO42-有强的氧化性,能杀菌消毒,本身被还原为Fe3+,Fe3+发生水解生成氢氧化铁胶体吸附水中的杂质,达到净水的目的.
(2)碱式硫酸铁[Fe(OH)SO4]是一种用于污水处理的新型高效絮凝剂,在医药上也可用于治疗消化性溃疡出血.工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁的工艺流程如图:

已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见表:
回答下列问题:
①写出反应I中发生的氧化还原反应的离子方程式Fe+2H+═Fe2++H2↑.
②加入少量NaHCO3的目的是调节溶液pH,应控制pH的范围为4.4~7.5.
③在实际生产中,反应II常同时通入O2以减少NaNO2的用量,若通入5.6L O2(标准状况),则相当于节约NaNO2的质量为69g.
④碱式硫酸铁溶于水后产生的[Fe(OH)]2+离子,可部分水解生成[Fe2(OH)4]2+聚合离子.该水解反应的离子方程式为2[Fe(OH)]2++2H2O?[Fe2(OH)4]2++2H+;.
II.铁的化合物也是制备高能锂电池的重要原料.已知磷酸亚铁锂电池总反应为:
FePO4+Li$?_{充电}^{放电}$LiFePO4,电池中的固体电解质可传导Li+.试写出该电池充电时的阳极反应式LiFePO4-e-═FePO4+Li+.常温下以该电池为电源电解200mL饱和食盐水,当消耗1.4g Li时,溶液的pH为14.(忽略溶液的体积变化).
I.水体的净化和污水的处理与铁及其化合物密切相关.
(1)自来水厂常用高铁酸钠(Na2FeO4)改善水质.简述高铁酸钠用于杀菌消毒同时又起到净水作用的原理FeO42-有强的氧化性,能杀菌消毒,本身被还原为Fe3+,Fe3+发生水解生成氢氧化铁胶体吸附水中的杂质,达到净水的目的.
(2)碱式硫酸铁[Fe(OH)SO4]是一种用于污水处理的新型高效絮凝剂,在医药上也可用于治疗消化性溃疡出血.工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁的工艺流程如图:

已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
①写出反应I中发生的氧化还原反应的离子方程式Fe+2H+═Fe2++H2↑.
②加入少量NaHCO3的目的是调节溶液pH,应控制pH的范围为4.4~7.5.
③在实际生产中,反应II常同时通入O2以减少NaNO2的用量,若通入5.6L O2(标准状况),则相当于节约NaNO2的质量为69g.
④碱式硫酸铁溶于水后产生的[Fe(OH)]2+离子,可部分水解生成[Fe2(OH)4]2+聚合离子.该水解反应的离子方程式为2[Fe(OH)]2++2H2O?[Fe2(OH)4]2++2H+;.
II.铁的化合物也是制备高能锂电池的重要原料.已知磷酸亚铁锂电池总反应为:
FePO4+Li$?_{充电}^{放电}$LiFePO4,电池中的固体电解质可传导Li+.试写出该电池充电时的阳极反应式LiFePO4-e-═FePO4+Li+.常温下以该电池为电源电解200mL饱和食盐水,当消耗1.4g Li时,溶液的pH为14.(忽略溶液的体积变化).
14.某溶液中,若忽略水的电离,只含有下表中所示的四种离子,试推测X离子及其个数b可能为( )
| 离子 | Na+ | Ba2+ | Cl- | X |
| 个数 | 3a | 2a | a | b |
| A. | NO3-、4a | B. | CO32-、3a | C. | OH-、6a | D. | SO42-、3a |
11.下列叙述正确的是( )
| A. | 臭氧空洞、温室效应、光化学烟雾、硝酸型酸雨的形成都与氮氧化合物有关 | |
| B. | 研制出性能优良的催化剂可使反应的温度降低,提高反应速率,从而起到很好的节能效果 | |
| C. | 同温同压下,H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件下△H 不同 | |
| D. | 光分解水制氢气、植物秸秆制沼气、高粱制乙醇都涉及到生物质能的利用 |
18.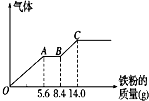 向 100mL 某稀硫酸和稀硝酸的混合溶液中逐渐加入铁粉,产生气体的量(相同状况)随铁粉 质量增加的变化如图所示(已知硝酸只被还原为 NO 气体).下列分析或结果错误的是( )
向 100mL 某稀硫酸和稀硝酸的混合溶液中逐渐加入铁粉,产生气体的量(相同状况)随铁粉 质量增加的变化如图所示(已知硝酸只被还原为 NO 气体).下列分析或结果错误的是( )
 向 100mL 某稀硫酸和稀硝酸的混合溶液中逐渐加入铁粉,产生气体的量(相同状况)随铁粉 质量增加的变化如图所示(已知硝酸只被还原为 NO 气体).下列分析或结果错误的是( )
向 100mL 某稀硫酸和稀硝酸的混合溶液中逐渐加入铁粉,产生气体的量(相同状况)随铁粉 质量增加的变化如图所示(已知硝酸只被还原为 NO 气体).下列分析或结果错误的是( )| A. | OA 段产生的是 NO,BC 段产生氢气,溶液中最终溶质为 FeSO4 | |
| B. | AB 段的反应为 Fe+2Fe3+═3Fe2+, | |
| C. | 原混合酸中NO3-物质的量为 0.3mol | |
| D. | H2SO4 浓度为 2.5 mol•L-1 |
15.为了证明某晶体中含有NH4+、K+、SO42-和H2O,下列实验叙述中不正确的是( )
| A. | 取少量晶体放入试管中,加热,若试管口上蘸有少量无水硫酸铜粉末的脱脂棉变蓝,则可证明晶体中含有结晶水 | |
| B. | 取少量晶体溶于水,加入少量NaOH溶液,加热,在试管口用湿润的蓝色石蕊试纸检验,若变红,则可证明晶体的成分中含有NH4+ | |
| C. | 取少量晶体溶于水,加适量稀盐酸,无现象,再滴入几滴BaCl2溶液,有白色沉淀生成,则可证明晶体的成分中含有SO42- | |
| D. | 取少量晶体溶于水,用洁净的铂丝蘸取少量溶液在酒精灯火焰上灼烧,火焰呈黄色,不能证明晶体中无K+ |
12.下列关于铁的描述不正确的是( )
| A. | 在FeSO4溶液中滴入KSCN溶液,溶液显红色 | |
| B. | 铁位于元素周期表中第4周期第Ⅷ族 | |
| C. | 在化合物中,铁通常呈现为+2,+3价 | |
| D. | 通常情况下,铁丝在氯气里燃烧时生成FeCl3 |
13.下列反应中属于加成反应的是( )
| A. | 乙炔的燃烧 | B. | 苯的硝化反应 | ||
| C. | 乙烷跟氯气反应生成一氯乙烷 | D. | 乙烯与氯化氢作用生成一氯乙烷 |