题目内容
【题目】甲烷的用途很广泛。
(1)已知:
2NO2(g )![]() N2O4(g) △H= -56.9kJ·mol -1
N2O4(g) △H= -56.9kJ·mol -1
H2 O(g)= H2O(l) △H= -44.0kJ·mol -1
CH4(g)+N2O4 (g)= N2(g)+2H2O(l)+CO2 (g) △H=-898.1kJ·mol -1
则 CH4 (g)催化还原NO2 (g)生成 N2(g)和H2O(g)的热化学方程式为_____________________。
(2)一定条件下,发生2NO(g)+2CO(g)![]() N2(g) +2CO2(g) △H<0。在不同时间c(NO)与c(CO)如下表所示:
N2(g) +2CO2(g) △H<0。在不同时间c(NO)与c(CO)如下表所示:

①该温度下,该反应的平衡常数表达式为K =_____________________;
②计算前4秒内氮气的平均反应速率为____________________;
③下列选项中,不能说明上述反应已达平衡的是( )
A.2v正(NO)= v逆(N2 )
B.容器中气体的平均分子量不随时间而变化
C.容器中气体的密度不随时间而变化
D.容器中CO的质量不再发生变化
E. 容器中气体的总压强不随时间而变化
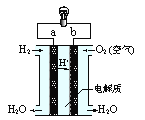
(3)CH4燃料电池原理如图所示

①该燃料电池的正极为_______________(填“a”或“b”)。该电池负极的电极反应式为_____________;
②放电一段时间后,电解质溶液的pH___________(填“增大”、“减小”或“不变”)。
【答案】(1)CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g), △H=-867kJ·mol -1
(2)① ![]() ②9.375×10-5mol/( L·s) 25% ③ AC
②9.375×10-5mol/( L·s) 25% ③ AC
(3)① b CH4+10OH--8e-=CO32-+7H2O ②减小
【解析】
试题分析:本题考查盖斯定律、反应速率及化学平衡、化学计算、电化学等。
(1)分别给三个方程式编号为①②③,根据盖斯定律①+③-2×②,可以得到对应的热化学方程式:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g), △H=-867kJ·mol -1。
(2)①根据化学式和平衡常数定义,可得 K=c(N2)·c2(CO2)/c2(NO)·c2(CO)。②根据化学反应速率公式可得:在前 4s内,c(NO)由1.00×10-3mol/L变为2.50×10-4mol/ L,改变了7 .50×10-4mol/ L,根据方程式中NO与N2的反应关系可知 N2浓度是7 .50×10-4mol/ L÷2=3.75×10-4mol/ L; 则 v(N2)= 3.75×10-4mol/ L÷4s = 9.375×10-5mol/( L·s); 达到平衡时,CO 的转化率为[(3.60×10-3mol/L-2.70×10-3mol/ L)÷3.60×10-3mol/L]×100% =25%;③根据方程式,当V正=V逆 ,已达平衡。 该反应为气体体积减小的反应,当压强平均相对分子质量不随时间而变化,已达平衡。

 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案【题目】类比法是一种重要的化学思维方法。下列各项中的已知和类比结论均正确的是
选项 | 已知 | 类比结论 |
A | 汞可以用热分解法冶炼 | 铜也可以用热分解法冶炼 |
B | Mg-Al插入稀H2SO4溶液中构成 原电池,Mg作负极 | Mg-Al插入稀NaOH溶液中构成原电池,Mg也作负极 |
C | 硫元素的最高正化合价为+6 | 氧元素的最高正化合价也为+6 |
D | Si是半导体材料 | Ge也可作半导体材料 |
A.AB.BC.CD.D