题目内容
无水AlCl3可用作有机合成的催化剂、食品膨松剂等.工业上由铝土矿(主要成分是Al2O3和Fe2O3)和石油焦(主要成分是碳单质)制备无水AlCl3的流程如下:

(1)在焙烧炉中发生反应:
①Fe2O3(s)+3C(s)?2Fe(s)+3CO(g);
②3CO(g)+Fe2O3(s)?2Fe(s)+3CO2(g).
则反应②的平衡常数的表达式为K=______.
(2)Al2O3、Cl2和C在氯化炉中高温下发生反应,当生成1mol AlCl3时转移______mol电子;炉气中含有大量CO和少量Cl2,可用Na2SO3溶液除去Cl2,其离子方程式为______.
(3)升华器中发生反应的化学方程式为______.
(4)工业上另一种由铝灰为原料制备无水AlCl3工艺中,最后一步是由AlCl3?6H2O脱去结晶水制备无水AlCl3,此反应必须在氯化氢的气流中加热,其原因是______.
已知SOCl2为无色液体且极易与水反应生成HCl和SO2,AlCl3?6H2O与SOCl2混合加热可制取无水AlCl3,写出该反应的化学方程式:______.
解:(1)可逆反应3CO(g)+Fe2O3(s)?2Fe(s)+3CO2(g)的化学平衡常数k= ,
,
故答案为: ;
;
(2)根据工艺流程可知氯化炉的产物,经冷却、升华可制备无水AlCl3,说明氯化炉的产物中含有AlCl3,冷凝器尾气含有CO,所以Al2O3、Cl2和C反应,生成AlCl3和CO,反应方程式为Al2O3+3Cl2+3C 2AlCl3+3CO,反应中氯元素化合价由0价降低为-1价,氯气是氧化剂,故生成1mol AlCl3时转移电子为1mol×3=3mol,
2AlCl3+3CO,反应中氯元素化合价由0价降低为-1价,氯气是氧化剂,故生成1mol AlCl3时转移电子为1mol×3=3mol,
Cl2有强氧化性,将SO32-氧化为SO42-,自身被还原为Cl-,反应离子方程式为SO32-+Cl2+H2O═SO42-+2Cl-+2H+,
故答案为:3;SO32-+Cl2+H2O═SO42-+2Cl-+2H+;
(3)由工艺流程可知,升华器中主要含有AlCl3和FeCl3,加入少量Al除去FeCl3,Al与FeCl3反应生成Fe、AlCl3,反应方程式为Al+FeCl3 AlCl3+Fe,
AlCl3+Fe,
故答案为:Al+FeCl3 AlCl3+Fe;
AlCl3+Fe;
(4)AlCl3的水解,直接加热,水解彻底生成氢氧化铝,得不到氯化铝,必须在氯化氢的气流中加热,目的是抑制AlCl3的水解,
由题目信息可知,AlCl3?6H2O与SOCl2混合加热生成AlCl3、HCl、SO2,反应方程式为AlCl3?6H2O+6SOCl2 AlCl3+12HCl↑+6SO2↑,
AlCl3+12HCl↑+6SO2↑,
故答案为:抑制AlCl3的水解,AlCl3?6H2O+6SOCl2 AlCl3+12HCl↑+6SO2↑.
AlCl3+12HCl↑+6SO2↑.
分析:(1)化学平衡常数,是指在一定温度下,可逆反应达到平衡时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值,据此书写,注意固体、醇液体不需要写出;
(2)根据工艺流程可知升华器中含有AlCl3等,所以Al2O3、Cl2和C反应会生成AlCl3,由冷凝器尾气可知还会生成CO,根据氯元素化合价变化计算注意电子数目;
Cl2有强氧化性,将SO32-氧化为SO42-,自身被还原为Cl-;
(3)由工艺流程可知,升华器中主要含有AlCl3和FeCl3,加入少量Al除去FeCl3,Al与FeCl3反应生成Fe、AlCl3;
(4)AlCl3的水解,直接加热,水解彻底生成氢氧化铝,得不到氯化铝;
由题目信息可知,AlCl3?6H2O与SOCl2混合加热生成AlCl3、HCl、SO2.
点评:本题考查化学平衡常数、对工艺流程的理解与条件控制、常用化学用语等,难度中等,理解工艺流程是解题的关键,是对学生综合能力的考查,需要学生具备扎实的基础,对学生的分析问题、解决问题的能力有较高的要求.
 ,
,故答案为:
 ;
;(2)根据工艺流程可知氯化炉的产物,经冷却、升华可制备无水AlCl3,说明氯化炉的产物中含有AlCl3,冷凝器尾气含有CO,所以Al2O3、Cl2和C反应,生成AlCl3和CO,反应方程式为Al2O3+3Cl2+3C
 2AlCl3+3CO,反应中氯元素化合价由0价降低为-1价,氯气是氧化剂,故生成1mol AlCl3时转移电子为1mol×3=3mol,
2AlCl3+3CO,反应中氯元素化合价由0价降低为-1价,氯气是氧化剂,故生成1mol AlCl3时转移电子为1mol×3=3mol,Cl2有强氧化性,将SO32-氧化为SO42-,自身被还原为Cl-,反应离子方程式为SO32-+Cl2+H2O═SO42-+2Cl-+2H+,
故答案为:3;SO32-+Cl2+H2O═SO42-+2Cl-+2H+;
(3)由工艺流程可知,升华器中主要含有AlCl3和FeCl3,加入少量Al除去FeCl3,Al与FeCl3反应生成Fe、AlCl3,反应方程式为Al+FeCl3
 AlCl3+Fe,
AlCl3+Fe,故答案为:Al+FeCl3
 AlCl3+Fe;
AlCl3+Fe;(4)AlCl3的水解,直接加热,水解彻底生成氢氧化铝,得不到氯化铝,必须在氯化氢的气流中加热,目的是抑制AlCl3的水解,
由题目信息可知,AlCl3?6H2O与SOCl2混合加热生成AlCl3、HCl、SO2,反应方程式为AlCl3?6H2O+6SOCl2
 AlCl3+12HCl↑+6SO2↑,
AlCl3+12HCl↑+6SO2↑,故答案为:抑制AlCl3的水解,AlCl3?6H2O+6SOCl2
 AlCl3+12HCl↑+6SO2↑.
AlCl3+12HCl↑+6SO2↑.分析:(1)化学平衡常数,是指在一定温度下,可逆反应达到平衡时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值,据此书写,注意固体、醇液体不需要写出;
(2)根据工艺流程可知升华器中含有AlCl3等,所以Al2O3、Cl2和C反应会生成AlCl3,由冷凝器尾气可知还会生成CO,根据氯元素化合价变化计算注意电子数目;
Cl2有强氧化性,将SO32-氧化为SO42-,自身被还原为Cl-;
(3)由工艺流程可知,升华器中主要含有AlCl3和FeCl3,加入少量Al除去FeCl3,Al与FeCl3反应生成Fe、AlCl3;
(4)AlCl3的水解,直接加热,水解彻底生成氢氧化铝,得不到氯化铝;
由题目信息可知,AlCl3?6H2O与SOCl2混合加热生成AlCl3、HCl、SO2.
点评:本题考查化学平衡常数、对工艺流程的理解与条件控制、常用化学用语等,难度中等,理解工艺流程是解题的关键,是对学生综合能力的考查,需要学生具备扎实的基础,对学生的分析问题、解决问题的能力有较高的要求.

练习册系列答案
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案
相关题目


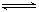 2CO2的平衡常数为K1;反应4Fe+3O2
2CO2的平衡常数为K1;反应4Fe+3O2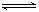 2Fe2O3的平衡常数K2,则反应3CO+Fe2O3
2Fe2O3的平衡常数K2,则反应3CO+Fe2O3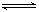 2Fe+3CO2的平衡常数K与K1、K2的关系式
2Fe+3CO2的平衡常数K与K1、K2的关系式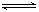 HSO3-+OH-
HSO3-+OH- 2AlCl3(g)+3CO(g)△H>0,欲提高金属铝的氯化效果,不可采取的措施是
2AlCl3(g)+3CO(g)△H>0,欲提高金属铝的氯化效果,不可采取的措施是

