题目内容
下列叙述中正确的是( )
| A、常温下,4g CH4含有NA个C-H极性共价键 | B、液态的HCl不能导电,所以HCl属于非电解质 | C、若M+和R2-的核外电子层结构相同,则原子序数:R>M | D、离子化合物中不一定含有离子键,含极性共价键的化合物不一定是共价化合物 |
分析:A.1个CH4分子中含有4个C-H,4g甲烷的物质的量=
=0.25mol;
B.HCl属于强电解质;
C.核外电子层结构相同的离子中,阴离子原子序数小于阳离子原子序数;
D.离子化合物中一定含有离子键,含有极性共价键的化合物不一定是共价化合物.
| 4g |
| 16g/mol |
B.HCl属于强电解质;
C.核外电子层结构相同的离子中,阴离子原子序数小于阳离子原子序数;
D.离子化合物中一定含有离子键,含有极性共价键的化合物不一定是共价化合物.
解答:解:A.1个CH4分子中含有4个C-H,4g甲烷的物质的量=
=0.25mol,1 mol CH4含有4 mol C-H共价键,即含有NA个C-H极性共价键,故A正确;
B.HCl是共价化合物,溶于水能电离出阴阳离子而导电,属于电解质,故B错误;
C.电子层结构相同的阴阳离子中,阳离子位于阴离子上一周期,所以M在R的下一周期,则原子序数:M>R,故C错误;
D.离子化合物中一定含有离子键,含有离子键的化合物一定是离子化合物,含有极性共价键的化合物不一定是共价化合物,如NaOH、NH4Cl等,故D错误;
故选A.
| 4g |
| 16g/mol |
B.HCl是共价化合物,溶于水能电离出阴阳离子而导电,属于电解质,故B错误;
C.电子层结构相同的阴阳离子中,阳离子位于阴离子上一周期,所以M在R的下一周期,则原子序数:M>R,故C错误;
D.离子化合物中一定含有离子键,含有离子键的化合物一定是离子化合物,含有极性共价键的化合物不一定是共价化合物,如NaOH、NH4Cl等,故D错误;
故选A.
点评:本题考查了化学键与化合物的关系、化学键的计算、基本概念等知识点,根据原子序数之间的关系、化学键和化合物的关系、基本概念等知识点来分析解答,易错选项是B,液态HCl不导电,但溶于水能导电.

练习册系列答案
相关题目
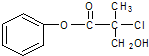 有机物A是农药生产中的一种中间体,结构简式如图所示.下列叙述中正确的是( )
有机物A是农药生产中的一种中间体,结构简式如图所示.下列叙述中正确的是( )| A、有机物A可以在一定条件下与HBr发生反应 | B、1mol A最多能与4mol H2发生加成反应 | C、有机物A与浓硫酸混合加热,可以发生消去反应 | D、1mol A与足量的NaOH溶液反应,最多可以消耗3mol NaOH |


