题目内容
2.下列方法可使海水转化为饮用水的是( )| A. | 过滤 | B. | 蒸馏 | C. | 活性炭吸附 | D. | 静置沉淀 |
分析 过滤、静置沉淀可以把不溶于水的物质除去;利用活性炭吸附可以除去水中的色素和异味;蒸馏可以得到较为纯净的水,据此解答.
解答 解:A.过滤可以除去不溶于水的物质,不能除去水中的氯化钠、氯化镁等物质,过滤后的水不能直接饮用,故A错误;
B.用蒸馏的方法可以得到纯净的水,可以作为饮用水,故B正确;
C.利用活性炭可以除去水中的色素和异味,不能除去水中的氯化钠、氯化镁等物质,过滤后的水不能直接饮用,故C错误;
D.静置沉淀可以除去水中的悬浮物,不能除去水中的氯化钠、氯化镁等物质,过滤后的水不能直接饮用,故D错误;
故选:B.
点评 本题主要考查净化水的方法,熟悉上述实验操作的原理是解题关键,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
12.(1)位于第4周期元素Q和T,在周期表中既处于同一周期又位于同一族,且原子序数T比Q多2.T的基态原子外围电子排布为3d84s2,Q2+的未成对电子数是4.
(2)Fe、Mn两元素的部分电离能数据列于下表:
比较两元素的I2、I3可知,气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难.对此,你的解释是由Mn2+转化为Mn3+时,3d能级由较稳定的3d5半充满状态转为不稳定的3d4状态需要的能量较多;而Fe2+到Fe3+时,3d能级由不稳定的3d6到稳定的3d5半充满状态,需要的能量相对要少.
(2)Fe、Mn两元素的部分电离能数据列于下表:
| 元 素 | Mn | Fe | |
| 电离能 /kJ•mol-1 | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
13. 为体现“绿色奥运”、“科技奥运”的理念,中国将在2008年北京奥运会时推出国产燃料电池汽车,作为马拉松领跑车和拍摄车,该车装有“绿色心脏”--质子交换膜燃料电池.下图是某科技杂志登载的该电池原理示意图.下列叙述正确的是( )
为体现“绿色奥运”、“科技奥运”的理念,中国将在2008年北京奥运会时推出国产燃料电池汽车,作为马拉松领跑车和拍摄车,该车装有“绿色心脏”--质子交换膜燃料电池.下图是某科技杂志登载的该电池原理示意图.下列叙述正确的是( )
 为体现“绿色奥运”、“科技奥运”的理念,中国将在2008年北京奥运会时推出国产燃料电池汽车,作为马拉松领跑车和拍摄车,该车装有“绿色心脏”--质子交换膜燃料电池.下图是某科技杂志登载的该电池原理示意图.下列叙述正确的是( )
为体现“绿色奥运”、“科技奥运”的理念,中国将在2008年北京奥运会时推出国产燃料电池汽车,作为马拉松领跑车和拍摄车,该车装有“绿色心脏”--质子交换膜燃料电池.下图是某科技杂志登载的该电池原理示意图.下列叙述正确的是( )| A. | 工作时,“阳极”周围溶液的酸性增强 | |
| B. | 氢气在电极上发生还原反应 | |
| C. | 图中标出的“阴极”实际是原电池的负极 | |
| D. | 工作过程中,质子(H+)从“阴极”一边透过质子交换膜移动到“阳极”一边与OH-反应生成水 |
7.下列叙述中,正确的是( )
| A. | 氧化还原反应的本质是元素化合价发生了变化 | |
| B. | 氧化还原反应的本质是反应中有电子的转移(得失或偏移) | |
| C. | 氧化剂在反应中被氧化 | |
| D. | 氧化反应一定先于还原反应发生 |
14.0.5L 1mol/L FeCl3溶液与3L 0.5mol/L KCl溶液中的Cl-的数目之比( )
| A. | 1:6 | B. | 1:1 | C. | 2:1 | D. | 3:1 |
11.以NA代表阿伏加德罗常数的值,则关于热化学方程式C2H2(g)+$\frac{5}{2}$O2(g)═2CO2(g)+H2O(l)△H=-1 300kJ•mol-1的说法中,正确的是( )
| A. | 当5NA个电子转移时,该反应放出1 300 kJ的能量 | |
| B. | 当NA个水分子生成且为液体时,吸收1 300 kJ的能量 | |
| C. | 当2NA个碳氧共用电子对生成时,放出1 300 kJ的能量 | |
| D. | 当8NA个碳氧共用电子对生成时,放出1 300 kJ的能量 |
12.下列情况下,反应速率相同的是( )
| A. | 等体积、等浓度的盐酸和硫酸分别与等质量的碳酸氢钠粉末反应 | |
| B. | 等质量的锌粒分别与等体积、等浓度的盐酸和硝酸反应 | |
| C. | 等体积、等浓度的盐酸和硝酸分别与等质量的碳酸钠粉末反应 | |
| D. | 等体积的0.2mol•L-1盐酸和0.1mol•L-1硫酸分别与同种石灰石反应 |
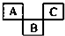 如图是元素周期表的一部分,A、B、C均为短周期元素,A、C两种元素的原子核外电子数之和等于B的质子数,B的原子核内质子数和中子数相等.
如图是元素周期表的一部分,A、B、C均为短周期元素,A、C两种元素的原子核外电子数之和等于B的质子数,B的原子核内质子数和中子数相等.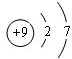 ;B的最高价氧化物对应的水化物的化学式为H2SO4.
;B的最高价氧化物对应的水化物的化学式为H2SO4.