题目内容
能证明碳酸比硅酸酸性强的实验事实是( )
| A、CO2是气体,SiO2是固体 | ||||
B、高温下能发生反应Na2CO3+SiO2
| ||||
| C、CO2通入Na2SiO3溶液中有胶状沉淀生成 | ||||
| D、CO2能溶于水生成碳酸,而SiO2却不溶于水 |
考点:弱电解质在水溶液中的电离平衡
专题:电离平衡与溶液的pH专题
分析:根据化学反应遵循强酸制弱酸的原则,比较碳酸比硅酸强的反应应在水溶液中进行.
解答:
解:A、氧化物的状态不能决定其水化物的酸性强弱,故A错误;
B、反应之所以能发生是因为生成了挥发性的气体二氧化碳,故B错误;
C、CO2+H2O+Na2SiO3═Na2CO3+H2SiO3↓,强酸能制弱酸,所以酸性:碳酸>硅酸,故C正确;
D、氧化物的水溶性不能决定其水化物的酸性强弱,故D错误;
故选C.
B、反应之所以能发生是因为生成了挥发性的气体二氧化碳,故B错误;
C、CO2+H2O+Na2SiO3═Na2CO3+H2SiO3↓,强酸能制弱酸,所以酸性:碳酸>硅酸,故C正确;
D、氧化物的水溶性不能决定其水化物的酸性强弱,故D错误;
故选C.
点评:本题考查学生硅酸的制取方法和酸性强弱的判断,难度不大,可以根据所学知识进行回答.

练习册系列答案
 走进文言文系列答案
走进文言文系列答案
相关题目
下列各组离子一定能在指定环境中大量共存的是( )
| A、在c(H+)=10-10mol/L的溶液中 Al3+、NH4+、Cl-、NO3- |
| B、使甲基橙呈红色的溶液 Fe3+、Na+、SO42-、NO3- |
| C、水电离出来的c(H+)=10-12mol/L的溶液 K+、HCO3-、Cl-、ClO- |
| D、含Al3+、CO32-、Na+、AlO2-的溶液 |
下列叙述正确的是( )
A、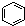 和 和 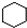 均是芳香烃, 均是芳香烃,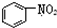 既是芳香烃又是芳香化合物 既是芳香烃又是芳香化合物 |
| B、分子式为C3H6Cl2的有机物共有5种同分异构体(不考虑立体异构) |
| C、分子式为C4H8有机物最多存在4个C-C单键 |
| D、分子式为C2H6O的红外光谱图上发现有C-H键和C-O键的振动吸收,由此可推测有机物结构简式为C2H5-OH |
把铁片放入下列溶液中,铁片溶解,溶液质量增加,也有气体放出的是( )
| A、稀硫酸 |
| B、Fe 2(SO4)3溶液 |
| C、CuSO4溶液 |
| D、NaNO3溶液 |
光导纤维被认为是20世纪最伟大的发明之一,它使信息高速公路在全球迅猛发展,它的发明者是被誉为“光纤之父”的华人科学家高锟.光导纤维的主要成分是( )
| A、CaCO3 |
| B、SiO2 |
| C、Na2SiO3 |
| D、CaSiO3 |
某温度下,将Cl2通入NaOH溶液中,反应得到含NaClO,NaClO3的混合液,经测定ClO-与ClO3-的浓度之比为1:1,则Cl2与NaOH溶液反应时被还原的氯元素与被氧化的氯元素的物质的量之比为( )
| A、21:5 | B、11:3 |
| C、3:1 | D、4:1 |
在甲、乙、丙、丁四个烧杯里分别放入0.1mol的钠,氧化钠,过氧化钠和氢氧化钠,然后各加入100mL水,使固体完全溶解,则甲、乙、丙、丁的溶液中溶质的质量分数大小的顺序为( )
| A、甲>乙>丙>丁 |
| B、丁<甲<乙=丙 |
| C、甲=丁<乙=丙 |
| D、丁<甲<乙<丙 |
 (1)药品分为处方药和非处方药.处方药是指必须在医生监控或指导下使用的药物,用符号
(1)药品分为处方药和非处方药.处方药是指必须在医生监控或指导下使用的药物,用符号