题目内容
铜和足量浓硫酸发生反应的化学方程式为______.在该反应中,若消耗了12.8g Cu,则转移了______mol 电子,生成______L SO2(标准状况)气体.向反应后的溶液中加水至溶液的体积为500mL,取出50mL,那么50mL溶液中CuSO4的物质的量浓度为______.
铜与浓硫酸在加热条件下反应生成硫酸铜、二氧化硫、水,反应方程式为:Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O;
12.8g Cu的物质的量=
=0.2mol,反应中Cu元素由0价升高为+2价,转移电子d 物质的量=0.2mol×2=0.4mol;
由方程式可知,n(SO2)=n(Cu)=0.2mol,故V(SO2)=0.2mol×22.4L/mol=4.48L;
50mL溶液中CuSO4的物质的量=0.2mol×
=0.02mol,CuSO4的物质的量浓度为
=0.4mol/L,
故答案为:Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O;0.4;4.48;0.4 mol/L.
| ||
12.8g Cu的物质的量=
| 12.8g |
| 64g/mol |
由方程式可知,n(SO2)=n(Cu)=0.2mol,故V(SO2)=0.2mol×22.4L/mol=4.48L;
50mL溶液中CuSO4的物质的量=0.2mol×
| 50mL |
| 500mL |
| 0.02mol |
| 0.05L |
故答案为:Cu+2H2SO4(浓)
| ||

练习册系列答案
相关题目
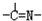 三种基团,无环状结构,三种基团的数目关系为n3=
三种基团,无环状结构,三种基团的数目关系为n3=
