题目内容
2.NA表示阿伏加德罗常数,下列叙述正确的是( )| A. | 1molC5H12O中含有的共价键数目为17NA | |
| B. | 1molNa2O和Na2O2混合物中含有的阴、阳离子总数是3.5NA | |
| C. | 在铁和氯气的反应中,1mol铁失去的电子数为2NA | |
| D. | 1L1mol/L的盐酸溶液中,所含氯化氢分子数为NA |
分析 A、C5H12O含17条共价键;
B、Na2O和Na2O2均由2个钠离子和1个阴离子构成;
C、氯气和铁反应后变为+3价;
D、HCl溶于水后完全电离为氢离子和氯离子.
解答 解:A、C5H12O中含17条共价键,故1mol中含17NA条共价键,故A正确;
B、Na2O和Na2O2均由2个钠离子和1个阴离子构成,故1molNa2O和Na2O2混合物中含有的阴、阳离子为3mol,即3NA个,故B错误;
C、氯气和铁反应后变为+3价,故1mol铁失去3NA个电子,故C错误;
D、HCl溶于水后完全电离为氢离子和氯离子,故盐酸溶液中无HCl分子,故D错误.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
17.下列说法中,正确的是( )
| A. | H2O是一种非常稳定的化合物,这是由于氢键所致 | |
| B. | 原子晶体中,共价键的键长越短,键能越大,熔点就越高 | |
| C. | 分子晶体中,共价键键能越大,该分子的熔沸点就越高 | |
| D. | 分子晶体中,分子间作用力越大,则分子越稳定 |
14.铯和钠都是第ⅠA族元素,以下关于铯的叙述,正确的是( )
| A. | 铯的密度比钠大,熔点比钠高 | |
| B. | 氢氧化铯易溶于水 | |
| C. | 铯能与热水反应放出氢气,但与冷水不反应 | |
| D. | 铯与氯形成共价化合物 |
1.已知:CH3Cl十2Na+CH3CH2Cl→CH3CH2CH3+2NaCl.现有两种一氯代物A和B,与金属钠发生的反应如下:A+2Na+B→C6H14+2NaCl,满足该条件的A和B的组台一共有( )
| A. | 14组 | B. | 20组 | C. | 26组 | D. | 32组 |
11.下列说法正确的是( )
| A. | 因为液态氨气化时吸热,可用液态氨作制冷剂 | |
| B. | 用铝制容器盛放浓硝酸,是因为铝和浓硝酸不反应 | |
| C. | 明矾溶于水生成氢氧化铝胶体,起消毒杀菌的作用 | |
| D. | 铝能置换出氧化铁中的铁,钢铁工业利用铝热反应冶炼铁 |
12.高锰酸钾[KMnO4]是常用的氧化剂.工业上以软锰矿(主要成分是MnO2)为原料制备高锰酸钾晶体.中间产物为锰酸钾[K2MnO4].图1是实验室模拟制备的操作流程:

相关资料:
①物质溶解度
②锰酸钾[K2MnO4]
外观性状:墨绿色结晶.其水溶液呈深绿色,这是锰酸根(MnO42-)的特征颜色.
化学性质:在强碱性溶液中稳定,在酸性、中性和弱碱性环境下,MnO42-会发生歧化反应.
试回答下列问题:
(1)煅烧软锰矿和KOH固体时,不采用石英坩埚而选用铁坩埚的理由是强碱腐蚀石英;
(2)实验时,若CO2过量会生成KHCO3,导致得到的KMnO4产品的纯度降低.请写出实验中通入适量CO2时体系中可能发生反应离子方程式:3MnO42-+2CO2═2MnO4-+MnO2↓+2CO32-,2OH-+CO2═CO32-+H2O(或3MnO42-+3CO2+2OH-═2MnO4-+MnO2↓+H2O+3CO32-);其中氧化还原反应中氧化剂和还原剂的质量比为1:2.
(3)由于CO2的通入量很难控制,因此对上述实验方案进行了改进,即把实验中通CO2改为加其他的酸.从理论上分析,选用下列酸中A,得到的产品纯度更高.
A.醋酸 B.浓盐酸 C.稀硫酸
(4)工业上采用惰性电极电解锰酸钾溶液制取高锰酸钾,试写出该电解反应的化学方程式2K2MnO4+2H2O$\frac{\underline{\;通电\;}}{\;}$2KMnO4+H2↑+2KOH.
提出改进方法:可用阳离子交换膜分隔两极区进行电解(如图2).
图2中A口加入的溶液最好为KOH溶液.使用阳离子交换膜可以提高Mn元素利用率的原因为阳离子交换膜防止锰酸根进入阴极区被还原.

相关资料:
①物质溶解度
| 物质 | KMnO4 | K2CO3 | KHCO3 | K2SO4 | CH3COOK |
| 20℃溶解度 | 6.4 | 111 | 33.7 | 11.1 | 217 |
外观性状:墨绿色结晶.其水溶液呈深绿色,这是锰酸根(MnO42-)的特征颜色.
化学性质:在强碱性溶液中稳定,在酸性、中性和弱碱性环境下,MnO42-会发生歧化反应.
试回答下列问题:
(1)煅烧软锰矿和KOH固体时,不采用石英坩埚而选用铁坩埚的理由是强碱腐蚀石英;
(2)实验时,若CO2过量会生成KHCO3,导致得到的KMnO4产品的纯度降低.请写出实验中通入适量CO2时体系中可能发生反应离子方程式:3MnO42-+2CO2═2MnO4-+MnO2↓+2CO32-,2OH-+CO2═CO32-+H2O(或3MnO42-+3CO2+2OH-═2MnO4-+MnO2↓+H2O+3CO32-);其中氧化还原反应中氧化剂和还原剂的质量比为1:2.
(3)由于CO2的通入量很难控制,因此对上述实验方案进行了改进,即把实验中通CO2改为加其他的酸.从理论上分析,选用下列酸中A,得到的产品纯度更高.
A.醋酸 B.浓盐酸 C.稀硫酸
(4)工业上采用惰性电极电解锰酸钾溶液制取高锰酸钾,试写出该电解反应的化学方程式2K2MnO4+2H2O$\frac{\underline{\;通电\;}}{\;}$2KMnO4+H2↑+2KOH.
提出改进方法:可用阳离子交换膜分隔两极区进行电解(如图2).
图2中A口加入的溶液最好为KOH溶液.使用阳离子交换膜可以提高Mn元素利用率的原因为阳离子交换膜防止锰酸根进入阴极区被还原.

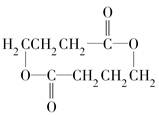 ;
;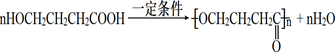 或
或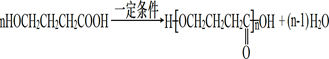 .
.