题目内容
常温常压下,O3为淡蓝色有特殊臭味的气体,工业上常用O3作为造纸、纺织等行业的漂白和脱色剂,也可用作饮用水的消毒和杀菌剂,但O3浓度超标时会因其强氧化性而对人体产生毒副作用。自然条件下打雷时空气中会有部分O2转化为O3。
实验室现提供以下装置和药品,请你完成O3的制备及性质验证实验。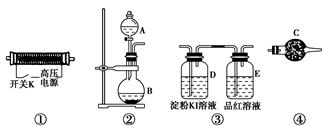
请回答以下问题:
(1)以上装置的连接顺序为______接______接________接________。
(2)A中应装入的试剂为________(写化学式);B中发生反应的化学方程式为____________________________________________________。
(3)检验整个装置的气密性的具体操作是__________________________。
(4)实验开始时,取下分液漏斗的塞子,断开电源开关K,再旋开分液漏斗的活塞,持续通入气体一段时间,其目的是________、________。然后合上电源开关K,试预测下列装置中可能观察到的现象及对应的结论。
D装置中:___________________________________________________;
E装置中:____________________________________________________。
(5)请指出该实验装置中的不妥之处并改进:_________________________。
(1)② ④ ① ③
(2)H2O2 2H2O2催化剂,2H2O+O2↑(或H2O 2Na2O2+2H2O=4NaOH+O2↑,注意对应)
(3)关闭分液漏斗的活塞,用热毛巾捂住烧瓶B,观察D、E的导管口是否有气泡冒出,松手片刻后观察导管内液面是否升高
(4)排出装置中的N2,防止生成氮氧化物干扰实验结果
导入O2进行对比实验,保证结果的准确性 无色溶液变蓝色,导管口产生气泡,试剂瓶上部有淡蓝色气体,证明O3有强氧化性 品红溶液褪色,导管口产生气泡,试剂瓶上部有淡蓝色气体,证明O3有漂白性
(5)没有尾气处理装置,应在E的导管口连接尾气处理装置
解析

 导学与测试系列答案
导学与测试系列答案 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如下: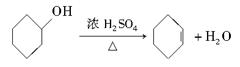
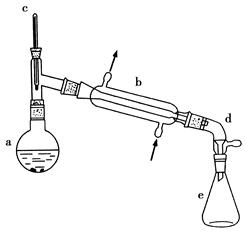
可能用到的有关数据如下:
| | 相对分子质量 | 密度 g/cm3 | 沸点/℃ | 溶解性 |
| 环己醇 | 100 | 0.9618 | 161 | 微溶于水 |
| 环己烯 | 82 | 0.8102 | 83 | 难溶于水 |
合成反应:
在a中加入20 g环己醇和2小片碎瓷片,冷却搅动下慢慢加入1 mL浓硫酸。b中通入冷却水后,开始缓慢加热a,控制馏出物的温度不超过90℃。
分离提纯:
反应粗产物倒入分液漏斗中分别用少量5%碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙。最终通过蒸馏得到纯净环己烯10 g。
回答下列问题:
(1)装置b的名称是________。
(2)加入碎瓷片的作用是________;如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是________(填正确答案标号)。
A.立即补加 B.冷却后补加 C.不需补加 D.重新配料
(3)本实验中最容易产生的副产物的结构简式为________。
(4)分液漏斗在使用前须清洗干净并________;在本实验分离过程中,产物应该从分液漏斗的________(填“上口倒出”或“下口放出”)。
(5)分离提纯过程中加入无水氯化钙的目的是________。
(6)在环己烯粗产物蒸馏过程中,不可能用到的仪器有________(填正确答案标号)。
A.圆底烧瓶 B.温度计 C.吸滤瓶 D.球形冷凝管
E.接收器
(7)本实验所得到的环己烯产率是________(填正确答案标号)。
A.41% B.50% C.61% D.70%
碳铵是一种较常使用的化肥,它在常温下易分解。某化学兴趣小组对碳铵的成分存在疑问,进行了如下探究。
【定性实验】检验溶液中的阴、阳离子。
取少量固体放入试管中,加入盐酸,把生成的气体通入澄清石灰水中,有白色沉淀生成。再另取少量碳铵放入试管中,加入浓NaOH溶液,加热,用湿润的红色石蕊试纸检验生成的气体,石蕊试纸变蓝色。
(1)根据实验现象,推测碳铵中所含有阴离子可能是 和 。
(2)据实验现象,碳铵与足量NaOH溶液加热反应的离子方程式可能是 。
【定量实验】测定碳铵中C元素和N元素质量比。
该兴趣小组准确称取ag碳铵,加热使之分解,并把产物通入碱石灰中,如下图所示。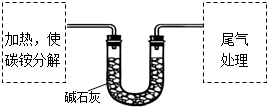
(1)碳铵固体应放在 中进行加热。
| A.试管 | B.蒸发皿 | C.烧瓶 | D.坩埚 |
A B C D
(3)若灼烧后没有固体残余,称量U形管在实验前后的质量差为bg。由此测得N元素的质量是 g。
(4)为了测定碳铵中碳元素的质量,他们设计的实验方案是将ag碳铵完全溶解于水,加入过量BaCl2,然后测定生成沉淀质量。请你评价该方案是否合理。 (填“合理”“不合理”),理由是 。
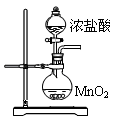
三氯化磷(PCl3)是一种重要的有机合成催化剂。实验室常用红磷与干燥的Cl2制取PCl3,装置如下图所示。
已知:红磷与少量Cl2反应生成PCl3,与过量Cl2反应生成PCl5。PCl3遇O2会生成POCl3(三氯氧磷), POCl3溶于PCl3,PCl3遇水会强烈水解生成H3PO3和HCl。PCl3、POCl3的熔沸点见下表。
| 物质 | 熔点/℃ | 沸点/℃ |
| PCl3 | -112 | 75.5 |
| POCl3 | 2 | 105.3 |
(1)B中所装试剂是 ,F中碱石灰的作用是 。
(2)实验时,检查装置气密性后,向D装置的曲颈甑中加入红磷,打开K3通入干燥的CO2,一段时间后,关闭K3,加热曲颈甑至上部有黄色升华物出现时通入氯气,反应立即进行。通干燥CO2的作用是 ,
(3)实验制得的粗产品中常含有POCl3、PCl5等。加入红磷加热除去PCl5后,通过 (填实验操作名称),即可得到较纯净的PCl3。
(4)C装置中的K1、K2的设计也出于类似的目的,为了达到这一实验目的,实验时与K1、K2有关的操作是 。
(5)实验后期关闭K1,打开K2,将气体通入C装置中发生反应,反应后的溶液为X。某同学设计实验来确定溶液X中含有的某些离子,请补充完成实验步骤和现象。
| 实验步骤 | 实验现象 | 实验结论 |
| ① | | 溶液X中含有Na+ |
| ② | | 溶液X中含有Cl- |
(5)玻璃管之间的连接需要用到胶皮管,连接的方法是:先把 ,然后稍稍用力即可把玻璃管插入橡皮管。甲同学将装置A的示意图画成右图,该示意图中明显的错误是 。
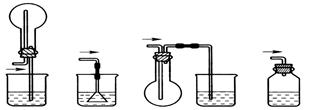
下列实验方案正确且能达到相应实验预期目的的是
 |  |  |  |
| A.制取少量蒸馏水 | B.制取少量NO2 | C.比较MnO2、Cl2、I2的氧化性 | D.探究NH4HCO3的热稳定性 |




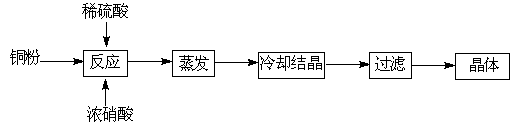
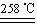 CuSO4+5H2O
CuSO4+5H2O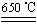 CuO+SO3↑,2SO3
CuO+SO3↑,2SO3 2SO2+O2
2SO2+O2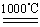 2Cu 2 O+O2↑
2Cu 2 O+O2↑