��Ŀ����
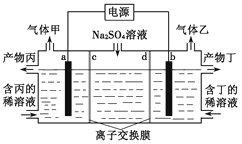
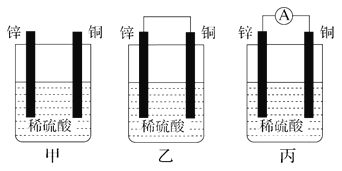
����Ŀ���мס�����λͬѧ��������ԭ��ط�Ӧ�������Ļ��˳�����˾���þƬ����Ƭ���缫������ͬѧ���缫����6 mol��L��1��H2SO4��Һ�У���ͬѧ���缫����6 mol��L��1��NaOH��Һ�У���ͼ��ʾ��

��1��д�����������ĵ缫��Ӧʽ___________________��
��2�����и�������Ϊ___________________�������ܷ�Ӧ�����ӷ���ʽ��___________________��
��3��������ͬѧ����Ϊ���������ԭ��صĵ缫���϶��ǽ������ɸ������ϵĽ���Ӧ�ȹ����������ϵĽ���������������жϳ�___________________��Ը�ǿ�����һ��жϳ�___________________��Ը�ǿ(��дԪ�ط���)��
��4���ɴ�ʵ��ó������н����У���ȷ����___________________��
A������ԭ��ط�Ӧ�жϽ������˳��ʱӦע��ѡ����ʵĽ���
B��þ�Ľ����Բ�һ�������Ľ�����ǿ
C����ʵ��˵���������˳����ѹ�ʱ��û��ʵ�ü�ֵ��
D����ʵ��˵����ѧ�о������ӣ���Ӧ������Ӱ��ϴ����Ӧ��������������
���𰸡� 2H����2e��===H2�� Al 2Al��2OH����2H2O===2AlO![]() ��3H2�� Mg Al AD
��3H2�� Mg Al AD
����������1���׳��л��ý���þ�����������������������ĵ缫��Ӧʽ��2H++2e-=H2������2���ҳ�����������������Һ������Ӧ���������������ĵ缫��ӦʽΪAl+4OH--3e-=AlO2��+2H2O���ܷ�Ӧ�����ӷ���ʽΪ2Al+2OH-+2H2O=2AlO2��+3H2������3������ס���ͬѧ����Ϊ������ԭ��صĵ缫����������ǽ������ɸ������ϵĽ���Ӧ�ȹ����������ϵĽ������ã�����жϳ�Mg��Ը�ǿ�����һ��жϳ�Al��Ը�ǿ����4��A.�������Ϸ�����֪����ԭ��ط�Ӧ�жϽ������˳��ʱӦע��ѡ����ʵĽ��ʣ�A��ȷ��B.þ�Ľ�����һ�������Ľ�����ǿ��B����C.�������˳���DZ���֤�ķ�Ӧ���ɣ������ʱ�����кܴ�ʹ�ü�ֵ��C����D.��ʵ��˵����ѧ�о������ӣ���Ӧ������Ӱ��ϴ����Ӧ����������������D��ȷ����ѡAD��

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�����Ŀ�����и������ʷ�����ȷ����
�� | �� | �� | ������ | |
A | ���� | ���� | ������ | �ɱ� |
B | ������ | �ռ� | ���� | ����ͭ |
C | ̼�� | ��ʯ�� | С�մ� | �������� |
D | ������̼ | ������ | ʳ�� | ʯ��ʯ |
A. A B. B C. C D. D