题目内容
5.在3NO2+H2O=2HNO3+NO↑反应中,氧化剂与还原剂的分子数之比为1:2.分析 3NO2+H2O=2HNO3+NO中,N元素的化合价由+4升高到+5,由+4降低到+2,NO2既是氧化剂又是还原剂,以此来解答.
解答 解:3NO2+H2O=2HNO3+NO中,N元素的化合价由+4降低到+2,则1molNO2作氧化剂,
N元素的化合价由+4升高到+5,则2molNO2作还原剂,
所以氧化剂与还原剂的分子个数比为1:2,
故答案为:1:2.
点评 本题考查氧化还原反应中的氧化剂与还原剂,明确元素的化合价变化是解答本题的关键,难度不大.

练习册系列答案
 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案
相关题目
15.四种短周期元素的性质或结构信息如下表.请根据信息回答下列问题.
(1)写出元素T的离子结构示意图 ;写出元素X的气态氢化物的电子式
;写出元素X的气态氢化物的电子式 ;离子半径比较:Y离子>Z离子(填“>”或“<”).
;离子半径比较:Y离子>Z离子(填“>”或“<”).
(2)Z单质与Y最高价氧化物的水化物的水溶液反应的离子方程式
2Al+2OH-+2H2O=2AlO2-+3H2↑.
(3)Z的最高价氧化物对应水化物的电离方程式AlO2-+H2O+H+?Al(OH)3?Al3++3OH-.
(4)元素T与氟元素相比,非金属性较强的是F(用元素符号表示),下列表述中能证明这一事实的是bc
a.常温下氟气的颜色比T单质的颜色深
b.氟气与T的氢化物剧烈反应,产生T的单质
c.氟与T形成的化合物中T元素呈正价态
d.比较两元素的单质与氢气化合时得电子的数目.
| 元素 | T | X | Y | Z |
| 性质 结构 信息 | 人体内含量最多的元素,且其单质是常见的助燃剂. | 单质为双原子分子,分子中含有3对共用电子对,常温下单质气体性质稳定,但其原子较活泼. | 单质质软、银白色固体、导电性强. 单质在空气中燃烧发出黄色的火焰. | 第三周期元素的简单离子中半径最小 |
 ;写出元素X的气态氢化物的电子式
;写出元素X的气态氢化物的电子式 ;离子半径比较:Y离子>Z离子(填“>”或“<”).
;离子半径比较:Y离子>Z离子(填“>”或“<”).(2)Z单质与Y最高价氧化物的水化物的水溶液反应的离子方程式
2Al+2OH-+2H2O=2AlO2-+3H2↑.
(3)Z的最高价氧化物对应水化物的电离方程式AlO2-+H2O+H+?Al(OH)3?Al3++3OH-.
(4)元素T与氟元素相比,非金属性较强的是F(用元素符号表示),下列表述中能证明这一事实的是bc
a.常温下氟气的颜色比T单质的颜色深
b.氟气与T的氢化物剧烈反应,产生T的单质
c.氟与T形成的化合物中T元素呈正价态
d.比较两元素的单质与氢气化合时得电子的数目.
20.下列叙述中正确的是( )
| A. | 仅由碳元素组成的物质一定是纯净物 | |
| B. | C60是碳的一种同素异形体 | |
| C. | C60的摩尔质量是720g | |
| D. | 石墨转变为金刚石不属于化学变化 |
10.现有下列各组物质:①甲烷和乙烯;②乙烯和乙醇;③苯和乙炔;④甲苯和邻二甲苯;⑤丙烯和2-丁烯,只要总质量一定,各组中两种物质不论以任何比例混合,完全燃烧时生成水的质量也总是定值的是( )
| A. | ②⑤ | B. | ②③④⑤ | C. | ③⑤ |
17.下列说法中正确的是( )
| A. | 吸热反应在不加热的条件下一定不能发生 | |
| B. | 放热反应在常温下一定很容易发生 | |
| C. | 由“100KPa时石墨转化为金刚石,要吸收1.895kJ的热能”可知在100KPa压强下石墨比金刚石稳定 | |
| D. | 化学反应中的能量变化,只表现为热能的变化 |
14.在测定某温度下1mol氢气的体积实验中,实验温度下,氢气的气体摩尔体积为24.5升,实验时称取镁带的质量要控制在0.100~0.110g之间,Mg与盐酸反应,液体量瓶的量程范围是( )
| A. | 100ml~120ml | B. | 100ml~120ml | C. | 110ml~130ml | D. | 100ml~130ml |
 有机物X的键线式为:
有机物X的键线式为: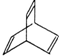
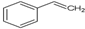
 .
.