题目内容
用金属钠制取氧化钠通常采用如下方法:2NaNO2+6Na=4Na2O+N2↑。不采用钠在氧气中燃烧而采用此法的原因是_______,反应中NaNO2作______剂,电子转移的数目是_______。见试题解析
【试题分析】
本题以信息形式给出制取氧化钠的化学方程式,若直接从化学方程式入手分析,很难直接理出头绪,但若从条件的反面,即不采用此法制取氧化钠,而用金属钠直接在空气或氧气中燃烧,会引起什么后果这一思路去分析,就易得出结论了。答案为:因为金属钠在空气或氧气中燃烧会生成Na2O2,而此法在N2环境中进行,Na2O不会被继续氧化为Na2O2;根据氮元素化合价变化情况,知NaNO2作氧化剂,电子转移的数目是6e-。

练习册系列答案
 同步学典一课多练系列答案
同步学典一课多练系列答案 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案
相关题目
下列离子方程式正确的是:
| A.金属钠投入CuSO4溶液中:2Na + Cu2+="Cu" + 2Na+ |
B.用浓盐酸与MnO2反应制取少量氯气:MnO2+2H++2Cl- Mn2++Cl2↑+2H2O Mn2++Cl2↑+2H2O |
| C.硫酸氢钠溶液与氢氧化钡溶液以等物质的量混合:SO42-+2H++Ba2++2OH-=BaSO4↓+2H2O |
| D.将SO2通入Ca(ClO)2溶液:Ca2++2ClO-+SO2+H2O=CaSO3↓+2HClO |
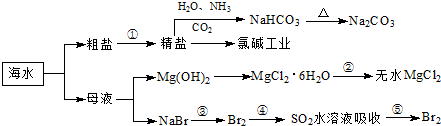
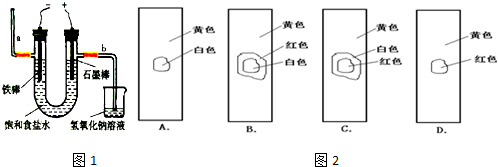
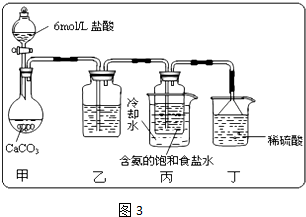
 Mn2++Cl2↑+2H2O
Mn2++Cl2↑+2H2O