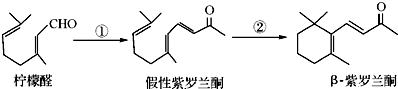
题目内容
11.已知:2CH3OH(g)+3O2(g)═2CO2(g)+4H2O(l)△H12CO(g)+O2(g)═2CO2(g)△H2
2H2(g)+O2(g)═2H2O(l)△H3
2H2(g)+O2(g)═2H2O(g)△H4
CO(g)+2H2(g)═CH3OH(g)△H5
下列关于上述反应焓变的判断正确的是( )
| A. | △H1>0,△H2<0 | B. | △H3>△H4 | ||
| C. | △H1=△H2+2△H3-△H5 | D. | 2△H5+△H1<0 |
分析 A.燃烧反应为放热反应;
B.生成液态产物放出的热量大于生成气态产物放出的热量;
C.根据盖斯定律计算;
D.氢气燃烧反应属于放热反应.
解答 解:A.2CH3OH(g)+3O2(g)═2CO2(g)+4H2O(l)△H1,2CO(g)+O2(g)═2CO2(g)△H2,燃烧反应为放热反应,则△H1<0,△H2<0,故A错误;
B.生成液态产物放出的热量大于生成气态产物放出的热量,反应热反应的△H<0,所以所以△H3<△H4,故B错误;
C.盖斯定律:△H1=△H2+2△H3-2△H5,故C错误;
D.氢气燃烧反应属于放热反应,已知2CH3OH(g)+3O2(g)═2CO2(g)+4H2O(l)△H1,2CH3OH(g)+3O2(g)═2CO2(g)+4H2O(l)△H1,则2△H5+△H1为氢气燃烧反应的反应热,所以2△H5+△H1<0,故D正确
故选D.
点评 本题考查了反应热的计算、盖斯定律的应用、反应热大小比较,题目难度不大,注意把握盖斯定律的原理及应用.

练习册系列答案
 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案
相关题目
1.某化学小组通过查阅资料,设计了如下图所示的方法以含镍废催化剂为原料来制备NiSO4•7H2O.已知某化工厂的含镍废催化剂主要含有Ni,还含有Al(31%)、Fe(1.3%)的单质及氧化物,其他不溶杂质(3.3%).

部分阳离子以氢氧化物形式沉淀时的pH如下:
(1)“碱浸”过程中发生反应的离子方程式是2Al+2OH-+2H2O=2AlO2-+3H2↑、Al2O3+2OH-=2AlO2-+3H2O.
(2)“酸浸”时所加入的酸是H2SO4 (填化学式);酸浸后,经操作a分离出固体①后,溶液中可能含有的金属离子是Ni2+、Fe2+、Fe3+.
(3)加入H2O2时发生反应的离子方程式为H2O2+2Fe2++2H+=2Fe3++2H2O.
(4)操作b为调节溶液的pH,你认为pH的调控范围是3.2-7.1.
(5)产品晶体中有时会混有少量绿矾(FeSO4•7H2O),其原因可能是H2O2的用量不足(或H2O2失效)、保温时间不足导致Fe2+未被完全氧化造成的(写出一点即可).
(6)NiS04•7H20可用于制备镍氢电池(NiMH),镍氢电池目前已经成为混合动力汽车的一种主要电池类型.NiMH中的M表示储氢金属或合金.该电池在充电过程中总反应的化学方程式是Ni(OH)2+M=NiOOH+MH,则NiMH电池放电过程中,正极的电极反应式为NiOOH+H2O+e-=Ni(OH)2+OH-.
(7)一般认为残留在溶液中的离子浓度小于1×10-5 mol/L时,沉淀已经完全.请利用上表中数据,估算Fe(OH)2的溶度积常数1×10-13.6(mol/L)3,和可逆反应Fe2++2H2O=2H++Fe(OH)2 在25℃时的平衡常数1×10-14.4(mol/L).

部分阳离子以氢氧化物形式沉淀时的pH如下:
| 沉淀物 | 开始沉淀时的pH | 完全沉淀时的pH |
| Al(OH)3 | 3.8 | 5.2 |
| Fe(OH)3 | 2.7 | 3.2 |
| Fe(OH)2 | 7.6 | 9.7 |
| Ai(OH)2 | 7.1 | 9.2 |
(2)“酸浸”时所加入的酸是H2SO4 (填化学式);酸浸后,经操作a分离出固体①后,溶液中可能含有的金属离子是Ni2+、Fe2+、Fe3+.
(3)加入H2O2时发生反应的离子方程式为H2O2+2Fe2++2H+=2Fe3++2H2O.
(4)操作b为调节溶液的pH,你认为pH的调控范围是3.2-7.1.
(5)产品晶体中有时会混有少量绿矾(FeSO4•7H2O),其原因可能是H2O2的用量不足(或H2O2失效)、保温时间不足导致Fe2+未被完全氧化造成的(写出一点即可).
(6)NiS04•7H20可用于制备镍氢电池(NiMH),镍氢电池目前已经成为混合动力汽车的一种主要电池类型.NiMH中的M表示储氢金属或合金.该电池在充电过程中总反应的化学方程式是Ni(OH)2+M=NiOOH+MH,则NiMH电池放电过程中,正极的电极反应式为NiOOH+H2O+e-=Ni(OH)2+OH-.
(7)一般认为残留在溶液中的离子浓度小于1×10-5 mol/L时,沉淀已经完全.请利用上表中数据,估算Fe(OH)2的溶度积常数1×10-13.6(mol/L)3,和可逆反应Fe2++2H2O=2H++Fe(OH)2 在25℃时的平衡常数1×10-14.4(mol/L).
2.化学与生活、社会密切相关,下列说法错误的是( )
| A. | 玻璃属于无机非金属材料 | B. | 煤的气化属于物理变化 | ||
| C. | 雾霾与汽车尾气的排放有关 | D. | 甲醛的水溶液可以用来浸泡标本 |
19.下列图示与对应的叙述相符的是( )


| A. | 图1表示相同温度下,相同体积、pH均为1的盐酸和醋酸溶液分别加水稀释时溶液pH的变化曲线,其中曲线Ⅱ为盐酸,且b点溶液的导电性比a点强 | |
| B. | 图2表示CH3COOH溶液中逐步加CH3COONa固体后,溶液pH的变化 | |
| C. | 图3表示某可逆反应正、逆反应速率随温度变化,则该反应的正反应是吸热反应 | |
| D. | 图4表示等量NO2在容积相同的恒容密闭容器中,不同温度下分别发生反应:2NO2(g)???N2O4(g),相同时间后测得NO2体积分数的曲线,则该反应的正反应△H<0 |
3.乳酸的结构简式为 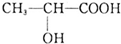 ,下列有关乳酸的说法中,不正确的是( )
,下列有关乳酸的说法中,不正确的是( )
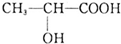 ,下列有关乳酸的说法中,不正确的是( )
,下列有关乳酸的说法中,不正确的是( )| A. | 乳酸中能发生酯化反应的官能团有2种 | |
| B. | 1 mol乳酸可与2 mol NaOH发生中和反应 | |
| C. | 1 mol乳酸与足量金属Na反应生成1 mol H2 | |
| D. | 有机物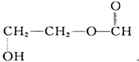 与乳酸互为同分异构体 与乳酸互为同分异构体 |
1.X、Y、Z、W四种短周期元素,原子序数依次增大.其中X的最外层电子数是最内层电子数的2倍,Y可形成双原子和三原子气体单质,Z和W形成的化合物中离子个数比为1:1,W的最高正价为+7价.则下列说法正确的是( )
| A. | Y形成的简单离子半径小于Z形成的简单离子半径 | |
| B. | X的氢化物稳定性弱于Y的氢化物稳定性 | |
| C. | 四种元素中,W的氧化物对应的水合物酸性最强 | |
| D. | Y与Z形成的两种化合物中所含有化学键类型相同 |
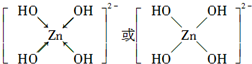 .
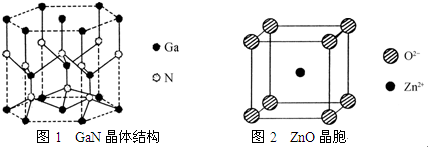
.
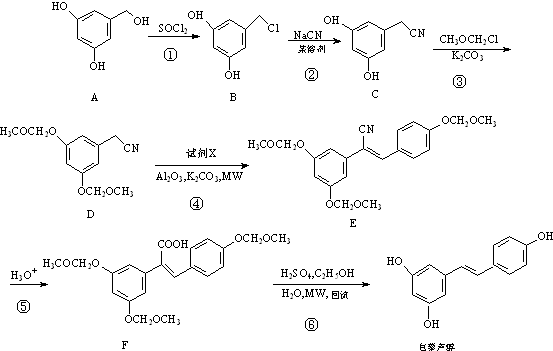
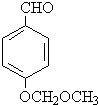 .
.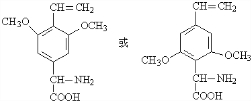 (任写一种).
(任写一种). .
. 的六元环结构,六元环上只有一个取代基
的六元环结构,六元环上只有一个取代基