题目内容
现有以下物质①NaCl溶液 ②干冰(固态的二氧化碳)③冰醋酸(纯净的醋酸)④铜⑤BaSO4固体 ⑥糖
⑦酒精 ⑧熔融的KNO3
其中能导电的是: .
属于电解质的是: .
属于非电解质的是: .
⑦酒精 ⑧熔融的KNO3
其中能导电的是:
属于电解质的是:
属于非电解质的是:
考点:电解质与非电解质,电解质溶液的导电性
专题:电离平衡与溶液的pH专题
分析:物质导电的条件是:含有自由电子或者自由移动的阴阳离子;
电解质是指:在水溶液中或熔融状态下能够导电的化合物;
非电解质是指:在水溶液里和熔融状态下都不导电的化合物;
电解质和非电解质必须是化合物,单质和混合物既不是电解质也不是非电解质.
电解质是指:在水溶液中或熔融状态下能够导电的化合物;
非电解质是指:在水溶液里和熔融状态下都不导电的化合物;
电解质和非电解质必须是化合物,单质和混合物既不是电解质也不是非电解质.
解答:
解:①NaCl溶液中存在自由移动的钠离子和氯离子,能导电;NaCl溶液是混合物,既不是电解质也不是非电解质;
②干冰是二氧化碳的固态形式,只存在分子,没有自由移动的离子,所以不能导电;二氧化碳在水溶液中与水反应生成碳酸,碳酸电离出自由移动的离子导电,二氧化碳自身不能电离,二氧化碳是非电解质;
③冰醋酸是醋酸的固态形式,只存在分子,没有自由移动的离子,所以不导电;但是冰醋酸溶液水后能电离出
醋酸根离子与氢离子而导电,属于电解质;
④铜是金属含有自由电子,能导电;铜是单质既不是电解质也不是非电解质;
⑤BaSO4固体没有自由移动的离子,不导电;熔融状态下的CaCO3能完全电离出自由移动的阴阳离子而使其导电,所以CaCO3是电解质;
⑥糖只存在分子,不含自由移动的离子,不导电;糖是化合物,其水溶液和熔融状态下都不导电,属于非电解质;
⑦酒精即乙醇,只存在乙醇分子,不含自由移动的离子,不导电;乙醇是化合物,其水溶液和熔融状态下都不导电,乙醇属于非电解质;
⑧熔融的KNO3能完全电离出自由移动的钾离子和硝酸根离子,能导电;它是化合物,属于电解质;
故答案为:①④⑧;③⑤⑧;②⑥⑦.
②干冰是二氧化碳的固态形式,只存在分子,没有自由移动的离子,所以不能导电;二氧化碳在水溶液中与水反应生成碳酸,碳酸电离出自由移动的离子导电,二氧化碳自身不能电离,二氧化碳是非电解质;
③冰醋酸是醋酸的固态形式,只存在分子,没有自由移动的离子,所以不导电;但是冰醋酸溶液水后能电离出
醋酸根离子与氢离子而导电,属于电解质;
④铜是金属含有自由电子,能导电;铜是单质既不是电解质也不是非电解质;
⑤BaSO4固体没有自由移动的离子,不导电;熔融状态下的CaCO3能完全电离出自由移动的阴阳离子而使其导电,所以CaCO3是电解质;
⑥糖只存在分子,不含自由移动的离子,不导电;糖是化合物,其水溶液和熔融状态下都不导电,属于非电解质;
⑦酒精即乙醇,只存在乙醇分子,不含自由移动的离子,不导电;乙醇是化合物,其水溶液和熔融状态下都不导电,乙醇属于非电解质;
⑧熔融的KNO3能完全电离出自由移动的钾离子和硝酸根离子,能导电;它是化合物,属于电解质;
故答案为:①④⑧;③⑤⑧;②⑥⑦.
点评:本题考查物质导电的条件、电解质和非电解质的概念,题目难度不大,注意电解质不一定导电,必须符合电离条件,产生自由移动离子,才能导电;导电的不一定时电解质,例如单质和电解质溶液.

练习册系列答案
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案
相关题目
根据现行元素周期表的排布规律,如果第七周期排满,下列预测正确的是( )
| A、第七周期共有50种元素 |
| B、第七周期最后一种元素不与任何物质发生反应 |
| C、第七周期ⅦA族元素的原子在化学反应中可以得到1个电子 |
| D、第七周期任何一种元素的原子最外层上不超过8个电子 |
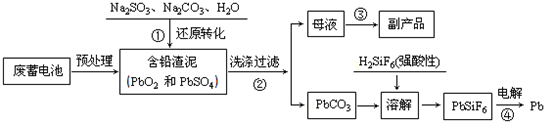

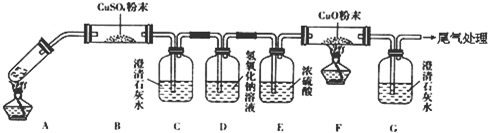
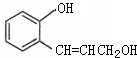
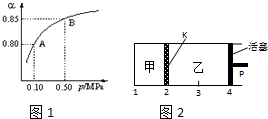 硫酸是重要的化工材料,二氧化硫生成三氧化硫是工业制硫酸的重要反应之一.
硫酸是重要的化工材料,二氧化硫生成三氧化硫是工业制硫酸的重要反应之一.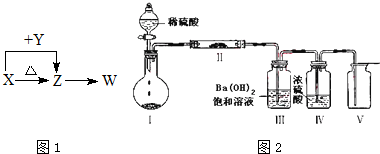
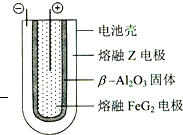 X、Y、Z、M、Q、G六种短周期元素,原子序数依次增大.X、Z同主族,可形成离子化合物ZX;Y、M同主族,Y的一种同位素原子常用于测定文物的年代;Q形成的单质为淡黄色固体.请回答下列问题(涉及物质均用化学式表示).
X、Y、Z、M、Q、G六种短周期元素,原子序数依次增大.X、Z同主族,可形成离子化合物ZX;Y、M同主族,Y的一种同位素原子常用于测定文物的年代;Q形成的单质为淡黄色固体.请回答下列问题(涉及物质均用化学式表示).