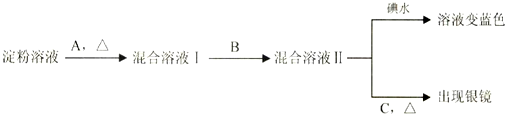
题目内容

(1)写出在催化转换器的前半部所发生反应的化学方程式(氮氧化物以NOx表示)
| ||
| △ |
| ||
| △ |
(2)若汽油(以辛烷计)进入气缸的速率为n mol?s-1,空气(假设空气中N2和O2体积比为4:1)进入汽缸的速率为m mol?s-1,则理论上催化转换器排出CO2的速率为:
(3)假定进入催化转换器的氮氧化物的物质的量为a,CO物质的量为b,碳氢化合物(以庚烷计)物质的量为c.求:
①在催化转换器的前半部消耗CO物质的量的范围
②在催化转换器的后半部消耗O2物质的量的范围
| b-2a |
| 2 |
| b-a |
| 2 |
| b-2a |
| 2 |
| b-a |
| 2 |
(2)根据方程式中物质之间的关系式进行计算;
(3)①根据方程式中氮氧化物和一氧化碳的关系式采用极限法进行计算;
②根据一氧化碳、庚烷分别和氧气的关系式进行计算.
| ||
| △ |
| ||
| △ |
(2)辛烷和氧气的反应方程式为:C8H18+
| 27 |
| 2 |
| ||
| △ |
1 8
n x
x=8n
(3)①2NOx+2xCO
| ||
| △ |
当x=1时,根据NO---CO得,消耗amolNO需要CO的物质的量是amol,当x=2时,根据NO2---2CO得,消耗amol二氧化氮需要CO的物质的量是2amol,实际上1<x<2,所以氮氧化物消耗一氧化碳的物质的量为
a<n(CO)<2a,故答案为:a<n(CO)<2a;
②通过①知剩余的CO的物质的量为b-2a<n(CO)<b-a,根据2CO+O2
| ||
| △ |
| b-2a |
| 2 |
| b-a |
| 2 |
根据C7H16+11O2
| ||
| △ |
所以一共需要氧气的物质的量为:
| b-2a |
| 2 |
| b-a |
| 2 |
故答案为:
| b-2a |
| 2 |
| b-a |
| 2 |

研究二氧化硫、氮氧化物、PM2.5等大气污染物的治理具有重要意义。
(1)对PM2.5样本用蒸馏水处理制成待测试样。若测得该试样中除H+和OH﹣外其它水溶性离子的化学组分及其平均浓度如下表:
|
离子 |
K+ |
Na+ |
NH4+ |
SO42- |
NO3﹣ |
Cl﹣ |
|
浓度/mol·L-1 |
4×10-6 |
6×10-6 |
2×10-5 |
4×10-5 |
3×10-5 |
2×10-5 |
根据表中数据判断试样的pH =
(2)含SO2的工业废气处理:废气的将含有SO2的废气通过装有石灰石浆液的脱硫装置可以除去其中的二氧化硫,在废气脱硫的过程中,所用的石灰石浆液在进入脱硫装置前,需通一段时间的二氧化碳,以增加其脱硫效率;脱硫时控制浆液的pH值,此时浆液含有的亚硫酸氢钙可以被氧气快速氧化生成硫酸钙。
二氧化碳与石灰石浆液反应得到的产物为 。
亚硫酸氢钙被足量氧气氧化生成硫酸钙的化学方程式为 。
(3)汽车尾气中NOx和CO的生成及转化。
①已知气缸中生成NO的反应为:N2(g)+O2(g) 2NO(g)
2NO(g)  H>0
H>0
汽车启动后,气缸温度越高,单位时间内NO排放量越大,原因是 。
②在汽车尾气系统中安装催化转化器,使NO和CO迅速发生反应转化成对环境无污染的气体,可减少CO和NO的污染,反应的化学方程式为 。
(4)用CH4催化还原NOx可消除氮的氧化物的污染。例如:
CH4(g)+4NO2(g)= 4NO(g)+CO2(g)+2H2O(g)△H=-574kJ·mol—1
CH4(g)+4NO(g)= 2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ·mol—1
H2O(g)= H2O(l)△H=-144kJ·mol—1
取标准状况下4.48LCH4还原NO2和NO的混合物,若氮氧化物完全被还原,且生成H2O(l),则放出的总热量Q的取值范围是 。