题目内容
4.下列说法正确的是( )| A. | NH3的摩尔质量为17g | |
| B. | 48gO3含有的臭氧分子数为6.02×1023 | |
| C. | 1mol•L-1NaCl溶液中含1molNa+ | |
| D. | 标准状况下,1molH2O的体积为22.4 L |
分析 A、摩尔质量单位为g/mol;
B、依据n=$\frac{m}{M}$=$\frac{N}{{N}_{A}}$计算分子数;
C、溶液体积不知不能计算微粒数;
D、标准状况下水为液体,标准状况下1mol气体摩尔体积为22.4L/mol.
解答 解:A、摩尔质量单位为g/mol,NH3的摩尔质量为17g/mol,故A错误;
B、依据n=$\frac{m}{M}$=$\frac{N}{{N}_{A}}$计算分子数,48gO3物质的量=$\frac{48g}{48g/mol}$=1mol,含有的臭氧分子数为6.02×1023,故B正确;
C、溶液体积不知不能计算微粒数,故C错误;
D、标准状况下1mol气体摩尔体积为22.4L/mol,标准状况下水为液体,故D错误;
故选B.
点评 本题考查了阿伏伽德罗常数的分析应用,主要是摩尔质量、气体摩尔体积概念的分析应用,掌握基础是解题关键,题目较简单.

练习册系列答案
 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案
相关题目
15.某烃的结构简式为: ,它的名称是( )
,它的名称是( )
 ,它的名称是( )
,它的名称是( )| A. | 3-乙基丁烷 | B. | 3-乙基戊烷 | C. | 2-乙基丁烷 | D. | 3-甲基戊烷 |
12.对于一定体积和条件下的可逆反应:N2+3H2?2NH3,能说明反应已达平衡状态的是( )
| A. | 百分组成 NH3%=N2% | B. | 气体的密度不变 | ||
| C. | 压强不变 | D. | c(H2):c(N2):c(NH3)=3:1:2 |
19.密闭的烧瓶里盛放气体A,在25℃时建立平衡:2A(g)?B(g)△H<0,把烧瓶置于100℃的沸水中,在建立新平衡的过程中,烧瓶内混合气体的物理量始终不变的是( )
| A. | 平均相对分子质量 | B. | 密度 | ||
| C. | 容器内的压强 | D. | 物质的量 |
16.我们每天生活在不断变化的物质世界里,以下属于化学变化的是( )
| A. | 冰雪融化 | B. | 干冰升华 | C. | 蜡烛燃烧 | D. | 酒精挥发 |
13.下列物质能够导电的是( )
| A. | 熔融的氢氧化钠 | B. | 硝酸钾溶液 | C. | 硫酸铜晶体 | D. | 无水乙醇 |
14.将Na2O2投入H2O中发生的反应为:2Na2O2+2H2O=4NaOH+O2↑.下列说法正确的是( )
| A. | 反应中H2O作还原剂 | |
| B. | Na2O2 和Na2O2 均属于碱性氧化物 | |
| C. | Na2O2晶体中阴、阳离子个数之比为1:1 | |
| D. | 反应中Na2O2既发生氧化反应,又发生还原反应 |
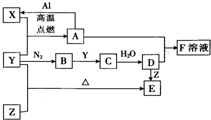 已知X、Y、Z为单质,其它为化合物.其中Y为气体,F溶液呈黄色,E是常见的温室气体,它们之间存在如下的转化关系(部分产物已经略去).请回答下列问题:
已知X、Y、Z为单质,其它为化合物.其中Y为气体,F溶液呈黄色,E是常见的温室气体,它们之间存在如下的转化关系(部分产物已经略去).请回答下列问题: