题目内容
16O中的16表示的含义是( )
| A.氧元素的相对原子质量 |
| B.氧元素的一种同位素的近似相对原子质量 |
| C.氧元素的近似相对原子质量 |
| D.氧元素的一种同位素的质量数 |
D
解析试题分析:在表示原子组成时元素符号的左下角表示质子数,左上角表示质量数,16O中的16表示的含义是氧元素的一种同位素的质量数,答案选D。
考点:考查原子组成的有关判断
点评:该题是基础性试题的考查,侧重对学生基础知识的巩固和检验,熟练记住即可,难度不大。明确原子组成的表示方法是答题的关键。

练习册系列答案
相关题目
同周期的X、Y、Z三种元素,常温下它们的气态氢化物的化学式为H2X、YH3、ZH4,下列说法正确的是( )
| A.气态氢化物的稳定性按X、Y、Z的顺序递减 |
| B.三种元素的含氧酸酸性:H4ZO4 > H3YO4> H2XO4 |
| C.元素的最高正价按X、Y、Z的顺序递减 |
| D.元素原子的半径按X、Y、Z的顺序递减 |
X、Y、Z、W是原子序数依次递增的4种短周期元素。其中X是周期表中原子半径最小的元素,Y原子最外层电子数是次外层电子数的3倍,Z原子的L层电子数比K层与M层电子数之和多5个,W在同周期元素中非金属性最强。下列说法正确的是( )
| A.X、Y、Z 3种元素组成的化合物中阴、阳离子所含电子数不等 |
| B.X与Z为同主族元素,它们的单质与W单质反应均失去电子 |
| C.Y、Z、W 3种元素组成的某种化合物可用于消毒 |
| D.Y与Z的单质在常温下反应生成Z2Y2 |
XY2是离子化合物,X和Y的离子的电子层结构与氖原子的相同,则X、Y为
| A.Na和Cl | B.K和S | C.Ca和F | D.Mg和F |
质量数为A,核内中子数为N的R2+离子与16O所形成的Wg氧化物中所含质子的物质的量为 ( )
A. mol mol | B.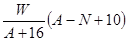 mol mol |
| C.(A-N+8)mol | D.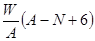 mol mol |
X元素最高氧化物对应的水化物为H3XO4,则它对应的气态氢化物为
| A.XH4 | B.XH3 | C.H2X | D.HX |
原子结构模型的演变图中,①为道尔顿实心球式原子模型、②为卢瑟福带核的原子模型、③为汤姆生葡萄干面包式原子模型、④为玻尔轨道式原子模型。其中符合历史演变顺序的一组排列是( )
① ② ③ ④
| A.①③②④ | B.①②③④ |
| C.①④③② | D.①③④② |
短周期元素的离子aW2+、bX+、cY2-、dZ-具有相同的电子层结构,下列推断正确的是
| A.热稳定性:H2Y<HZ | B.原子半径:W>X>Z>Y |
| C.离子半径:W2+>Y2- | D.碱性:XOH<W(OH)2 |
元素周期表是学习物质结构和性质的重要工具。请参照元素①-⑦在周期表中的位置,回答下列问题:
| ① | | | ||||||
| | | | | ② | ③ | ④ | | |
| ⑤ | | ⑥ | ⑦ | | | | | |
(1)元素⑦在元素周期表的位置为______________,
(2)由原子个数比为1:1:1的①、②、③ 三种元素组成共价化合物X,共形成4对共用电子对,X的结构式为 。
(3)⑥的最高价氧化物与⑤的最高价氧化物对应的水化物在溶液中进行的的离子反应方程式__________________________________。
(4)由表中两种元素的原子按1:1组成的离子化合物常用作供氧剂,该化合物中的化学键类型为_____________________。
(5)A、B、D、E是由上述部分元素组成的化合物,它们之间的转化关系如图所示(部分产物已略去)。A、B、D的焰色反应均呈黄色,水溶液均为碱性。请回答:

①E的电子式为 。
②自然界中存在B、D和H2O按一定比例结晶而成的固体。取一定量该固体溶于水配成100 mL溶液,测得溶液中金属阳离子的浓度为0.5 mol/L。若取相同质量的固体加热至质量不再发生变化,剩余固体的质量为 g。