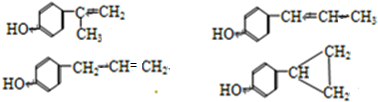
题目内容
5.按要求完成下列填空•(1)元素X的原子有3个电子层,最外层有4个电子•这种元素位于周期表第三周期ⅣA族.
(2)用“>”、“<”或“=”填空.熔点:氮化钠>碘单质:稳定性:PH3<NH3.
(3)短周期中,最高价氧化物对应的水化物碱性最强的物质是NaOH(填化学式).
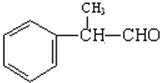
(4)下列各组物质中互为同分异构体的是B(填编号)
A、红磷和白磷 B、CH3CH2CH2CH3 和
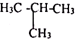 C、${\;}_{6}^{12}$C和${\;}_{6}^{14}$C D、甲烷和丙烷.
C、${\;}_{6}^{12}$C和${\;}_{6}^{14}$C D、甲烷和丙烷.
分析 (1)周期序数等于电子层数,最外层电子数等于主族序数,由此分析解答;
(2)离子晶体的熔沸点大于分子晶体;中心元素非金属性越强对应氢化物越稳定;
(3)短周期中,最高价氧化物对应的水化物碱性最强的物质,是金属性最强的钠,所以是碱性最强的是氢氧化钠;
(4)同分异构体是指分子式相同,但结构不同的化合物,同分异构体包含碳链异构、官能团异构、位置异构等,以此来解答.
解答 解:(1)因为元素X的原子有3个电子层,所以第三周期,最外层有4个电子,所以是第ⅣA族,即第三周期ⅣA族,故答案为:第三周期ⅣA族;
(2)离子晶体的熔沸点大于分子晶体,氮化钠是离子晶体,而碘单质是分子晶体,所以熔点:氮化钠>碘单质;中心元素非金属性越强对应氢化物越稳定,非金属性:N>P,所以稳定性:PH3<NH3,故答案为:>;<;
(3)短周期中,最高价氧化物对应的水化物碱性最强的物质,是金属性最强的钠,所以是碱性最强的是氢氧化钠,故答案为:NaOH;
(4)A、红磷和白磷是同素异形体,故不选; B、CH3CH2CH2CH3 和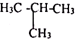 ,两都分子式相同,但结构不同,是同分异构体,故选;
,两都分子式相同,但结构不同,是同分异构体,故选;
C、${\;}_{6}^{12}$C和${\;}_{6}^{14}$C,质子数相同,而中子数不同的原子,互称同位素,故不选; D、甲烷和丙烷,是同系物,故不选;
故选B.
点评 本题考查了元素在同期表中的位置、氢化物的稳定性和同分异构体的判断、有机物的结构,难度不大,注意对同分异构体定义的理解,注意同分异构体、同素异形体、同系物、同位素的区别.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
16.下列有关电解质溶液中微粒的物质的量浓度关系正确的是( )
| A. | 物质的量浓度相等的①(NH4)2CO3②(NH4)2SO4③(NH4)2Fe(SO4)2三种溶液,c(NH4+)的大小顺序为:①>②>③ | |
| B. | 在0.1mol•L-1Na2CO3溶液中:c(OH-)-c(H+)=c(HCO3-)+2c(H2CO3) | |
| C. | 向0.2mol•L-1NaHCO3溶液中加入等体积0.1mol•L-1NaOH溶液:c(CO32-)>c(HCO3-)>c(OH-)>c(H+) | |
| D. | 0.2mol•L-1HCl与0.1mol•L-1NaAlO2溶液等体积混合:c(Cl-)>c(Na+)>c(Al3+)>c(H+)>c(OH-) |
13.已知如下数据:
下列说法不正确的是( )
| 化学键 | 键能/(kJ•mol-1) | 化学键 | 键能/(kJ•mol-1) |
| H-H | 436.0 | I-I | 153 |
| O=O | 497.0 | N=N | 946 |
| O-H | 463.0 | H-I | 297 |
| N-H | 391.0 |
| A. | 氢气的燃烧热为△H=-483kJ/mol | |
| B. | H2(g)+I2(g)$\frac{200℃}{\;}$2HI(g)△H=-5kJ/mol | |
| C. | N2(g)+3H2(g)?2NH3(g)△H=-92kJ/mol | |
| D. | 在相同条件下,等量的氢气完全燃烧和与氧气组成燃烧电池时,焓变相等 |
17.对于可能存在的第119号元素,有人称之为“类钫”.根据周期表结构及元素性质变化趋势,判断下列有关“类钫”的预测说法正确的是( )
| A. | “类钫”对于的氢氧化物不溶于水 | B. | “类钫”不能再空气中稳定存在 | ||
| C. | “类钫”单质不与水反应 | D. | “类钫”单质有较高的熔点 |
14.海水提镁的主要流程如图,下列说法正确的是( )


| A. | 流程中的反应全部都是非氧化还原反应 | |
| B. | M是盐酸 | |
| C. | 电解熔融MgO比电解熔融MgCl2制金属镁更节约能量 | |
| D. | 操作b只是过滤 |
15.下列各组离子能大量共存,当加入相应试剂后会发生化学变化,且发生反应的离子方程式正确的是( )
| 选项 | 离子组 | 加入试剂 | 加入试剂后发生反应的离子方程式 |
| A | Fe2+、NO3-、NH4+ | NaHSO4溶液 | 3Fe2++NO3-+4H+═3Fe3++NO↑+2H2O |
| B | Ca2+、HCO3-、Cl- | 少量NaOH溶液 | Ca2++2HCO3-+2OH-═2H2O+CaCO3↓+CO32- |
| C | K+、AlO2-、HCO3- | 通入少量CO2 | 2AlO2-+3H2O+CO2═2Al(0H)3↓+CO32- |
| D | NH4+、Al3+、SO42- | 少量Ba(OH)2 溶液 | 2 NH4++2SO42-+Ba2++2OH═BaSO42-+2NH3•H2O |
| A. | A | B. | B | C. | C | D. | D |
 ,请回答以下问题:
,请回答以下问题: