题目内容
【题目】pC类似于pH,是指极稀溶液中的溶质浓度的常用对数的负值。如某溶液中某溶质的浓度为1×10-3 mol·L-1,则该溶液中该溶质的pC=-lg(1×10-3)=3。如图为25℃时H2CO3溶液的pC-pH图(若离子浓度小于10-5 mol·L-1,可认为该离子不存在)。下列说法不正确的是
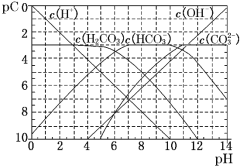
A.某温度下,CO2饱和溶液的浓度是0.05 molL-1,其中1/5的CO2转变为H2CO3,若此时溶液的pH约为5,据此可得该温度下CO2饱和溶液中H2CO3的电离度约为0.1% ,
B.25℃时,H2CO3一级电离平衡常数的数值Ka1=10-6
C.向Na2CO3溶液中滴加盐酸至pH等于11时,溶液中:c(Na+)+c(H+)=2c(CO32﹣)+c(OH﹣)+c(HCO3﹣)
D.25℃时,0.1 mol·L-1Na2CO3中c(HCO3﹣)比0.1 mol·L-1NaHCO3中c(HCO3﹣)大
【答案】CD
【解析】
试题分析:A.某温度下,CO2饱和溶液的浓度是0.05molL-1,其中![]() 的CO2转变为H2CO3,则H2CO3的浓度为0.01mol/L,电离度为
的CO2转变为H2CO3,则H2CO3的浓度为0.01mol/L,电离度为![]() ×100%=0.1%,故A正确;B.由图象可知当pH=6时,c(H+)=10-6mol/L,pC(H2CO3)=pC(HCO3-),Ka1(H2CO3)=
×100%=0.1%,故A正确;B.由图象可知当pH=6时,c(H+)=10-6mol/L,pC(H2CO3)=pC(HCO3-),Ka1(H2CO3)=![]() =10-6,故B正确;C.向Na2CO3溶液中滴加盐酸至pH等于11时,溶液中存在电荷守恒:c(Na+)+c(H+)=c(OH-)+c(Cl-)+c(HCO3-)+2c(CO32-),故C错误;D.碳酸根的水解程度大于碳酸氢根的水解程度,但水解程度都较小,25℃时,0.1 mol·L-1Na2CO3中c(HCO3﹣)比0.1 mol·L-1NaHCO3中c(HCO3﹣)小,故D错误;故选CD。
=10-6,故B正确;C.向Na2CO3溶液中滴加盐酸至pH等于11时,溶液中存在电荷守恒:c(Na+)+c(H+)=c(OH-)+c(Cl-)+c(HCO3-)+2c(CO32-),故C错误;D.碳酸根的水解程度大于碳酸氢根的水解程度,但水解程度都较小,25℃时,0.1 mol·L-1Na2CO3中c(HCO3﹣)比0.1 mol·L-1NaHCO3中c(HCO3﹣)小,故D错误;故选CD。