题目内容
13.现有中学化学常见四种金属单质A、B、C、I和三种常见气体甲、乙、丙及物质D、E、F、G、H.它们之间能发生如下反应(图中有些反应的产物和反应的条件没有全部标出)
请根据以上信息回答下列问题:
(1)写出物质H的化学式:Fe(OH)3,物质E的名称:盐酸;
(2)写出反应①的离子方程式2Na+2H2O=2Na++2OH-+H2↑;写出反应③的化学方程式2Al+2Na+2H2O=2NaAlO2+3H2↑;写出反应⑦的离子方程式2Fe3++Cu=2Fe2++Cu2+.
分析 金属A焰色反应为黄色,故A为金属Na,乙是黄绿色气体,乙为Cl2,红褐色沉淀H为Fe(OH)3;由反应①Na→气体甲+D,为Na与水的反应,生成甲为H2,D为NaOH,由NaOH+金属B→H2可知,B为金属Al,由甲+乙→丙,故丙为HCl,HCl溶于水的物质E,故E为盐酸;G+NaOH→Fe(OH)3,G含有Fe3+,由E(盐酸)$\stackrel{C}{→}$F$\stackrel{Cl_{2}}{→}$G可知,盐酸与金属C反应,生成的产物F还能继续与氯气反应,则金属C为变价金属,应为Fe,所以F为FeCl2,G为FeCl3,FeCl3与红色金属I反应生成FeCl2,则I为Cu,据此答题.
解答 解:(1)由上面的分析可知,H的化学式为Fe(OH)3,物质E的名称为盐酸,故答案为:Fe(OH)3; 盐酸;
(2)反应①为Na与水反应生成氢氧化钠和氢气,离子方程式为2Na+2H2O=2Na++2OH-+H2↑;
反应③为铝和氢氧化钠溶液反应生成偏铝酸钠和氢气,化学方程式为2Al+2Na+2H2O=2NaAlO2+3H2↑;
反应⑦为FeCl3与Cu反应生成FeCl2,离子方程式为2Fe3++Cu=2Fe2++Cu2+,
故答案为:2Na+2H2O=2Na++2OH-+H2↑;2Al+2Na+2H2O=2NaAlO2+3H2↑;2Fe3++Cu=2Fe2++Cu2+.
点评 本题以无机框图题的形式考查Na、Al、Fe、Cl等元素单质及其化合物之间的相互转化关系、化学用语的书写、方程式的书写等,难度中等,注意基础知识的掌握.

练习册系列答案
 新编小学单元自测题系列答案
新编小学单元自测题系列答案
相关题目
3.氧化还原反应中,水的作用可以是氧化剂、还原剂、既是氧化剂又是还原剂、既非氧化剂又非还原剂等.下列反应与Br2+SO2+2H2O=H2SO4+2HBr相比较,水的作用不相同的是( )
| A. | 3NO2+H2O→2HNO3+NO | B. | 4Fe(OH)2+O2+2H2O→4Fe(OH)3 | ||
| C. | 2F2+2H2O→4HF+O2 | D. | 2H2O$\stackrel{通电}{→}$O2+2H2↑ |
4.在实验室用下列装置制取氯气并验证氯气的某些化学性质,其中能达到实验目的是( )
| A. |  用装置制取氯气 | B. |  用装置除去氯气中的HCl | ||
| C. |  用装置收集一试管氯气 | D. | 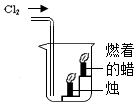 用装置验证氯气能支持 H2燃烧 |
1.某黄酮类药物的合成涉及反应 .下列说法正确的是( )
.下列说法正确的是( )
 .下列说法正确的是( )
.下列说法正确的是( )| A. | 化合物X在空气中能稳定存在 | |
| B. | 化合物X中所有碳原子可处于同一平面 | |
| C. | 化合物X、Y都可与溴水发生加成反应 | |
| D. | 1 mol化合物Y最多可以与4 mol H2反应 |
8.下列各组离子在溶液中能大量共存的是( )
| A. | Al3+、K+、OH-、NO3- | B. | Ba2+、Na+、SO42-、OH- | ||
| C. | H+、K+、CH3COO-、Cl- | D. | K+、Na+、Cl- |
18.下列关于SO2的叙述中不正确的是( )
| A. | 可用向上排空气法收集 | B. | 与水反应生成硫酸 | ||
| C. | 可用于漂白纸浆、草帽等 | D. | 不能与氯化钡溶液发生反应 |
5.下列说法正确的是( )
| A. | 铁质罐头盒内层镀上一层耐腐蚀的锡,用于防止铁被腐蚀 | |
| B. | 将氯气通入紫色石蕊试液中先变红后褪色,因氯气具有漂白性 | |
| C. | 从海水中提取物质都必须通过化学反应才能实现 | |
| D. | 相同条件下,CuS在CuSO4溶液中的Ksp比在纯水中更小 |
2.下列关于实验基本操作的说法错误的是( )
| A. | 玻璃仪器洗涤干净倒掉水后,水在仪器上应既不能成滴也不能成股流下 | |
| B. | 环形玻璃搅拌棒材料若用铜代替,则测量出的中和热数值偏大 | |
| C. | 将玻璃导管蘸水后,边旋转边向橡皮导管中插入使其连接起来 | |
| D. | 做银镜反应实验后的试管内壁附有银,可用稀硝酸清洗 |