题目内容
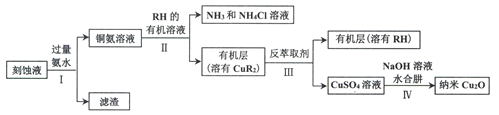
【题目】某学习小组以电路板刻蚀液(含有大量Cu2+、Fe2+、Fe3+)为原料制备纳米Cu20,制备流程如下:
已知:①Cu2O在潮湿的空气中会慢慢氧化生成CuO,也易被还原为Cu; Cu2O不溶于水,极易溶于碱性溶液;Cu2O+2H+ =Cu2++Cu+H2O。
②生成Cu2O的反应:4Cu(OH)2+N2H4H2O=2Cu2O+N2↑+7H2O
请回答:
(1)步骤II,写出生成CuR2反应的离子方程式:____________________________
(2)步骤II,需对水层多次萃取并合并萃取液的目的是___________________________
(3)步骤III,反萃取剂为_____________
(4)步骤IV,①制备纳米Cu2O时,控制溶液的pH为5的原因是_______________
A.  B.
B.  C.
C. 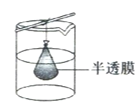
②从溶液中分离出纳米Cu2O采用离心法,下列方法也可分离Cu2O的是_________
③Cu2O干燥的方法是_________________
(5)为测定产品中Cu2O的含量,称取3.960g产品于锥形瓶中,加入30mL硫酸酸化的Fe2(SO4)3溶液(足量),充分反应后用0.2000 mol·L-1标准KMnO4溶液滴定,重复2~3次,平均消耗KMnO4溶液50.00mL。
①产品中Cu2O的质量分数为_______
②若无操作误差,测定结果总是偏高的原因是_____
【答案】Cu(NH3)42++2RH=2NH4++2NH3+CuR2 提高铜离子的萃取率,提高原料利用率 稀硫酸 pH太小氧化亚铜会发生歧化反应,pH太大,氧化亚铜会溶解 C 真空干燥 90.90% 制备氧化亚铜时,氧化亚铜被肼还原,产品中含有铜粉,测定结果均增大
【解析】
刻蚀液(含有大量Cu2+、Fe2+、Fe3+)加入过量的氨水,形成铜氨溶液,同时生成氢氧化亚铁和氢氧化铁沉淀,铜氨溶液中加入有机溶液得到CuR2,再反萃取剂条件下生成硫酸铜溶液。
(1)步骤II,铜氨溶液和RH的有机溶液反应生成氨气和氯化铵和CuR2,离子方程式为:Cu(NH3)42++2RH=2NH4++2NH3+CuR2;
(2)需要对水层多次萃取并合并萃取液是能提高铜离子的萃取率,提高原料利用率;
(3)通过前后的物质分析,反萃取剂提供硫酸根离子和氢离子,故为稀硫酸;
(4)①从信息分析,氧化亚铜在酸性强的溶液中会发生歧化反应,但碱性强的溶液中氧化亚铜会溶解。故答案为:pH太小氧化亚铜会发生歧化反应,pH太大,氧化亚铜会溶解;
②纳米Cu2O不能通过半透膜,所以可以选择C进行分离。
③因为Cu2O在潮湿的空气中会慢慢氧化生成CuO,也易被还原为Cu,所以选择真空干燥;
(5)①根据得失电子分析关系式有5Cu2O---2KMnO4,高锰酸钾的物质的量为0.200 0 moI.L-1×0.05L=0.01mol,则氧化亚铜的物质的量为0.025mol,质量分数为![]() =90.90%;
=90.90%;
②制备氧化亚铜时,肼具有还原性,氧化亚铜被肼还原,产品中含有铜粉,测定结果均增大。

 阅读快车系列答案
阅读快车系列答案【题目】已知25 ℃时部分弱电解质的电离平衡常数数据如下表:
弱酸化学式 | HSCN | CH3COOH | HCN | H2CO3 |
电离平衡常数 | 1.3×101 | 1.7×105 | 6.2×1010 | K1=4.3×107 K2=5.6×1011 |
回答下列问题:
(1)写出碳酸的第一级电离平衡常数表达式:K1=_______________________。
(2)等物质的量浓度的a.CH3COONa、b.NaCN、c.Na2CO3、d.NaHCO3溶液的pH由大到小的顺序为________(填字母)。
(3)常温下,0.1 mol·L1的CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是________(填序号)
A.[H+] B.[H+]/[CH3COOH]
C.[H+]·[OH] D.[OH]/[H+]
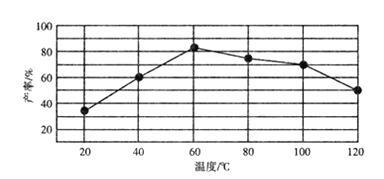
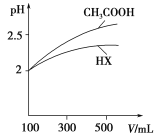
(4)体积均为100 mL pH=2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示,则HX的电离平衡常数________(填“大于”、“小于”或“等于”)CH3COOH的电离平衡常数。
(5)写出少量CO2通入次氯酸钠溶液中的离子方程式:_____________________________。