题目内容
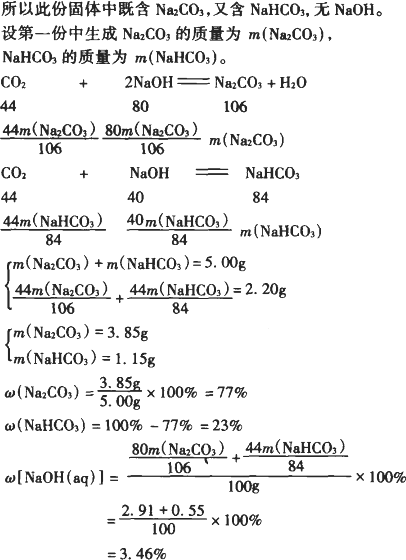
现取两种质量分数不同的NaOH溶液各100 g,分别向其中缓慢地通入2.2 g CO2.当CO2气体全部被吸收后,将溶液在减压、低温下蒸干,分别得到干燥的不含结晶水的固体5.00 g和6.00 g,计算:
(1)所得固体中各组分的质量分数.
(2)NaOH溶液的质量分数.
答案:
解析:
提示:
解析:
|
|
提示:
|
CO2与NaOH反应后的生成物,可能是Na2CO3,也可能是NaHCO3,或是Na2CO3与NaHCO3的混合物.NaOH可能剩余也可能无剩余,NaOH有剩余时生成物只能是Na2CO3.因为NaHCO3与NaOH不能共存. |

练习册系列答案
相关题目