题目内容
【题目】科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池.已知H2(g)、CO(g)和CH3OH(l)的燃烧热△H分别为﹣285.8kJmol﹣1、﹣283.0kJmol﹣1和﹣726.5kJmol﹣1 . 请回答下列问题:
(1)用太阳能分解10mol水消耗的能量是kJ.
(2)甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为 .
(3)在容积为2L的密闭容器中,由CO2和H2合成甲醇,在其他条件不变得情况下,考察温度对反应的影响,实验结果如图所示(注:T1、T2均大于300℃).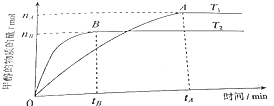
判断该可逆反应达到化学平衡状态的标志是(填字母).
①.v生成(CH3OH)=v消耗(CO2) ②.混合气体的密度不再改变
③.CO2、H2、CH3OH的浓度均不再变化 ④.混合气体的压强不再改变
(4)在直接以甲醇为燃料电池中,电解质溶液为酸性,负极的反应式为、正极的反应式为 . 理想状态下,该燃料电池消耗1mol甲醇所能产生的最大电能为702.1kJ,则该燃料电池的理论效率为(燃料电池的理论效率是指电池所产生的最大电能与燃料电池反应所能释放的全部能量之比).
【答案】
(1)2858
(2)CH3OH(l)+O2(g)=CO(g)+2 H2O(l)△H=﹣443.5kJmol﹣1
(3)③④
(4)CH3OH+H2O﹣6e﹣═CO2+6H+;O2+4H++4e﹣═2H2O;96.64%
【解析】解:(1)由H2(g)的燃烧热△H为﹣285.8kJmol﹣1知,1molH2(g)完全燃烧生成1molH2O(l)放出热量285.8kJ,即分解1mol H2O(l)为1molH2(g)消耗的能量为285.8kJ,则分解10mol H2O(l)消耗的能量为285.8kJ×10=2858kJ,故答案为:2858;②由CO(g)和CH3OH(l)的燃烧热△H分别为﹣283.0kJmol﹣1和﹣726.5kJmol﹣1 , 则①CO(g)+1/2O2(g)=CO2(g)△H=﹣283.0kJmol﹣1②CH3OH(l)+3/2O2(g)=CO2(g)+2H2O(l)△H=﹣726.5kJmol﹣1由盖斯定律可知用②﹣①得反应CH3OH(l)+O2(g)=CO(g)+2H2O(l),该反应的反应热△H=﹣726.5kJmol﹣1﹣(﹣283.0kJmol﹣1)=﹣443.5kJmol﹣1 , 故答案为:CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=﹣443.5kJmol﹣1;(3)由CO2和H2合成甲醇,其反应为CO2(g)+3H2(g)CH3OH(g)+H2O(g)①.生成甲醇为正反应速率,消耗二氧化碳为正反应速率,都是正反应速率,不能判断反应是否达到平衡状态,故错误;②.在容积为2L的密闭容器中,气体的体积不变,质量守恒,所以混合气体的密度始终不变,不能根据密度判断反应是否达到平衡状态,故错误;③.随着反应进行CO2、H2的浓度逐渐减小,CH3OH的浓度逐渐增大,当各物质的浓度保持不变,说明反应达到平衡状态,故正确;④.该反应是气体减少的反应,随着反应进行气体的物质的量减少,则混合气体的压强减小,当混合气体的压强不再改变,说明反应达到平衡状态,故正确.故答案为:③④;(4)甲醇燃料电池,甲醇在负极失电子发生氧化反应生成二氧化碳,则负极的电极方程式为:CH3OH+H2O﹣6e﹣═CO2+6H+ , 氧气在正极上得电子生成水,正极发生的电极反应式是:O2+4H++4e﹣═2H2O;1mol甲醇完全燃烧放出726.5kJ能量,已知的1mol甲醇所能产生的最大电能为702.1kJ,则该燃料电池的理论效率为 ![]() ×%=96.64%.故答案为:CH3OH+H2O﹣6e﹣═CO2+6H+;O2+4H++4e﹣═2H2O;96.64%. (1)由氢气的燃烧热可知水分解吸收的能量,然后利用化学计量数与反应热的关系来计算;(2)根据CO和CH3OH的燃烧热先书写热方程式,再利用盖斯定律来分析甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式;(3)反应达到平衡状态时,正逆反应速率相等但不等于0,平衡时各种物质的物质的量、浓度等不再发生变化,可由此进行判断;(4)甲醇燃料电池,甲醇在负极失电子发生氧化反应生成二氧化碳,氧气在正极上得电子生成水;1mol甲醇完全燃烧放出726.5kJ能量,根据已知的1mol甲醇所能产生的最大电能计算.
×%=96.64%.故答案为:CH3OH+H2O﹣6e﹣═CO2+6H+;O2+4H++4e﹣═2H2O;96.64%. (1)由氢气的燃烧热可知水分解吸收的能量,然后利用化学计量数与反应热的关系来计算;(2)根据CO和CH3OH的燃烧热先书写热方程式,再利用盖斯定律来分析甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式;(3)反应达到平衡状态时,正逆反应速率相等但不等于0,平衡时各种物质的物质的量、浓度等不再发生变化,可由此进行判断;(4)甲醇燃料电池,甲醇在负极失电子发生氧化反应生成二氧化碳,氧气在正极上得电子生成水;1mol甲醇完全燃烧放出726.5kJ能量,根据已知的1mol甲醇所能产生的最大电能计算.





