题目内容
【题目】高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压.高铁电池的总反应为:3Zn+2K2FeO4+8H2O ![]() 3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述不正确的是( )
3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述不正确的是( )
A.放电时负极反应为:Zn﹣2e﹣+2OH﹣=Zn(OH)2
B.充电时阳极反应为:Fe(OH)3﹣3e﹣+5OH﹣=FeO42﹣+4H2O
C.放电时每转移3 mol电子,正极有1 mol K2FeO4被氧化
D.放电时正极附近溶液的碱性减弱
【答案】CD
【解析】解:A、根据电池的总反应可知,高铁电池放电时必定是锌在负极失去电子,电极反应式为Zn﹣2e﹣+2OH﹣=Zn(OH)2,故A正确;
B、充电时阳极发生Fe(OH)3失电子的氧化反应,即反应为:Fe(OH)3﹣3e﹣+5OH﹣=FeO42﹣+4H2O,故B正确;
C、放电时正极反应为FeO42+4H2O+3e﹣=Fe(OH)3+5OH﹣,每转移3mol电子,正极有1molK2FeO4被还原,故C错误;
D、放电时,高铁酸钾在正极得到电子,电极反应式为FeO42+4H2O+3e﹣=Fe(OH)3+5OH﹣,所以正极附近溶液的碱性增强,故D错误.
故选CD.

【题目】下表是A、B、C三种有机物的有关信息:
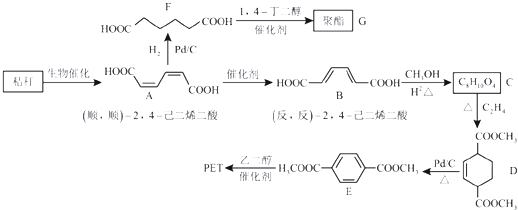
A | ①能使溴的四氧化碳溶液褪色;②比例模型为: ③能与水在一定条件下反应生成C |
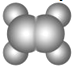
B | ①由C、H、O三种元素组成;②球棍模型为 |
C | ①由C、H、O三种元素组成;②能与Na反应,但不能与NaOH溶液反应; ③能与B反应生成相对分子质量为88的酯 |
请结合信息回答下列问题:
(1)写出A与溴的四氯化碳溶液反应的化学方程式____________________________,反应类型为______________。
(2)A与氢气发生加成反应后生成物质D,写出符合下列要求的有机物的结构简式:_______。
①与D互为同系物 ②分子中碳原子总数是4 ③分子里带有一个支链
(3)对于物质B有关说法正确的是_____ (填序号) 。
①无色无味液体 ②有毒 ③易溶于水 ④具有酸性,能与碳酸钙反应 ⑤官能团是-OH
(4)写出在浓硫酸作用下,B与C反应生成酯的化学方程式________________________________。
(5)下列试剂中,能用于检验C中是否含有水的是______ (填序号)。
①CuSO4·5H2O ②无水硫酸铜 ③浓硫酸 ④金属钠
【题目】冬季是流感多发季节,最近我校许多学生得了流感,表现症状为发热头痛等,乙酰苯胺是磺胺类药物具有很好退热镇痛作用,是较早使用的解热镇痛药,有“退热冰”之称。其制备原理如下:
![]()
己知:①苯胺易被氧化:
②乙酰苯胺、苯胺和醋酸的部分物理性质如下表:
物质 | 熔点 | 沸点 | 溶解度(20℃) |
乙酰苯胺 | 114.3℃ | 305℃ | 0.46 |
苯胺 | -6℃ | 184.4℃ | 3.4 |
醋酸 | 16.6℃ | 118℃ | 易溶 |
注:刺形分馏柱的作用相当于二次蒸馏,用于沸点差别不太大的混合物的分离。

实验步骤如下:
步骤1:在50mL烧瓶中加入9mL(0.10mol)苯胺、15mL(0.27mol)冰醋酸及少许锌粉,依照上图装置组装仪器。
步骤2:控制温度计示数约105℃,小火加热回流1h。
步骤3:趁热将反应混合物倒入盛有100mL冷水的烧杯中,冷却后抽滤,洗涤,得到粗产品。
步骤4:将步骤3所得粗产品进一步提纯后,称得产品质量为10.8g。
请回答下列问题:
(1)步骤1中加入锌粉的作用是________________________________。
(2)步骤2加热可用_________________(填“水浴”或“油浴”)
(3)锥形瓶所接的蒸馏物是______________(填化学式)。实验这样设计的目的是__________________。
(4)步骤2中,控制温度计读数在105℃左右的原因_______________,得到的粗产品需进一步提纯,该提纯方法是________________________________________________________。
(5)纯净的乙酰苯胺为无色片状晶体,对无色片状晶体进行干燥,判断晶体干燥完全的实验方法是___________________________________________。
(6)请计算所得到乙酰苯胺的产率是_________________________________________________。