��Ŀ����
����Ŀ�������ҹ�������ǿ��������CO2���⻯�ϳɼ״������Ĺ�ҵ�������о���ʵ�ֿɳ�����չ��
(1)��֪��CO2(g)+H2(g) H2O(g) +CO(g) ��H1 = + 41.1 kJmol-1
CO(g)+2H2(g) CH3OH(g) ��H2=��90.0 kJmol-1
д��CO2���⻯�ϳɼ״����Ȼ�ѧ����ʽ��___________________________________________��
(2)Ϊ���CH3OH���ʣ�������Ӧ���õ�������_______������ĸ����
a�����¸�ѹ b�����µ�ѹ c�����µ�ѹ d�����¸�ѹ
(3)250�桢�ں����ܱ���������CO2(g)���⻯�ϳ�CH3OH(g)����ͼΪ��ͬͶ�ϱ�[n(H2)/n(CO2)]ʱij��Ӧ��Xƽ��ת���ʱ仯���ߡ�
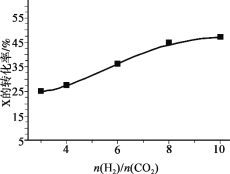
��Ӧ��X��_______������CO2������H2������
(4)250�桢�����Ϊ2.0L�ĺ����ܱ������м���6mol H2��2mol CO2�ʹ�����10minʱ��Ӧ�ﵽƽ�⣬���c(CH3OH) = 0.75 mol�� L��1��
�ٻ�ѧƽ�ⳣ��K = _______��
�ڴ����ͷ�Ӧ�����뷴Ӧ��ת���ʺͲ����ѡ�����и߶���ء�������ͬͶ�ϱȺ���ͬ��Ӧʱ�䣬����ʵ���������£�
ʵ���� | �¶ȣ�K�� | ���� | CO2ת���ʣ�%�� | �״�ѡ���ԣ�%�� |
A | 543 | Cu/ZnO���װ� | 12.3 | 42.3 |
B | 543 | Cu/ZnO����Ƭ | 11.9 | 72.7 |
C | 553 | Cu/ZnO���װ� | 15.3 | 39.1 |
D | 553 | Cu/ZnO����Ƭ | 12.0 | 70.6 |
�����ϱ��������ݣ���CO2�����״�������ѡ��Ϊ_______������ĸ����
���𰸡�3H2 (g)+CO2 (g) ![]() CH3OH(g)+H2O(g) ��H=��48.9 kJ/mol d CO2 5.33 B
CH3OH(g)+H2O(g) ��H=��48.9 kJ/mol d CO2 5.33 B
��������
��1��������֪�Ȼ�ѧ����ʽ�����ø�˹���ɽ��з���������+�ڿɵ�CO2���⻯�ϳɼ״����Ȼ�ѧ����ʽ�����ݴ˼����ʱ䣻
��2�����������CH3OHƽ��ת���ʣ���Ҫʹƽ�����������ƶ������ƽ���ƶ�ԭ��������
��3������ͬһ��Ӧ����������һ�ַ�Ӧ���Ũ�ȣ��������һ�ַ�Ӧ���ת���ʣ����ͼʾ�������ʾ[n(H2)/n(CO2)]�����з������
��4������������ʽ����ƽ��ʱ����ֵ����ʵ���Ũ�ȣ��ٸ��ݻ�ѧƽ�ⳣ��Ϊ������Ũ����֮���뷴Ӧ��Ũ����֮���ıȣ�����ƽ�ⳣ����
�ڷֱ�Ա�AB��CDʵ�飬Cu/ZnO����Ƭ����ʹ��Ӧ�������ӣ��״�ѡ���Ըߣ��Ա�BDʵ�飬�¶����ߣ�CO2ת�������ߣ����״���ѡ����ȴ���ͣ��ݴ˷�����
��1����֪����CO2(g)+H2(g) H2O(g) +CO(g) ��H1 = + 41.1 kJmol-1��
��CO(g)+2H2(g) CH3OH(g) ��H2=��90.0 kJmol-1��
���ø�˹���ɿ�֪������+�ڿɵã�CO2(g)+3H2(g)CH3OH(g)+H2O(g)����H=(+41.1kJ/mol)+(90kJ/mol)=48.9kJ/mol��
�ʴ�Ϊ��CO2(g)+3H2(g)CH3OH(g)+H2O(g) ��H=48.9kJ/mol��
��2��CO2(g)+3H2(g)CH3OH(g)+H2O(g) ��H=48.9kJ/mol���÷�Ӧ�Ƿ�Ӧǰ�����������С�ķ�Ӧ����ѹƽ�������ƶ�������ӦΪ���ȷ�Ӧ������ƽ�������ƶ�����Ϊ���CH3OHƽ��ת���ʣ���ƽ���������ƶ������õ�����Ϊ���¸�ѹ��
�ʴ�Ϊ��d��
��3��ͬһ��Ӧ����������һ�ַ�Ӧ���Ũ�ȣ��������һ�ַ�Ӧ���ת���ʣ�������ת���ʽ��ͣ�ͼʾ���ź���������[n(H2)/n(CO2)]���൱��C(CO2)����ʱ������C(H2)��ƽ�������ƶ���ʹ������̼��ת��������������ת���ʽ��ͣ�����XΪCO2��
�ʴ�Ϊ��CO2��
��4���ٸ�����֪��Ϣ�����г�����ʽ��
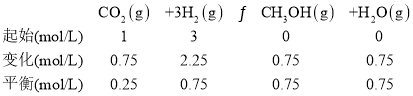
��ѧƽ�ⳣ��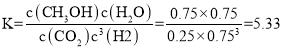 ��
��
�ʴ�Ϊ��5.33��
���ֱ�Ա�AB��CDʵ�飬��ͬ���¶��£�Cu/ZnO����Ƭ����ʹ��Ӧ�������ӣ��״�ѡ���Ըߣ�����ѡ��BD���бȽϣ�ͬ�����������£��¶����ߣ�CO2ת�������ߣ����״���ѡ����ȴ���ͣ�������CO2�����״�������ѡ��ΪB��
�ʴ�Ϊ��B��

����Ŀ����һ���������İ���������������Ƶ��ܱ����������![]() ��������������䣬��������������Բ���
��������������䣬��������������Բ���![]() ��ʹ��ﵽ�ֽ�ƽ�⣺
��ʹ��ﵽ�ֽ�ƽ�⣺![]() ��ʵ���ò�ͬ�¶��µ�ƽ�����������±���
��ʵ���ò�ͬ�¶��µ�ƽ�����������±���
�¶� |
|
|
|
|
|
ƽ��������Ũ�� |
|
|
|
|
|
�����й�������ȷ����
A.�ÿ��淴Ӧ�ﵽƽ��ı�־֮һ�ǻ������ƽ����Է�����������
B.��÷�Ӧ![]() ��
��![]() �������ڵ������Է�����
�������ڵ������Է�����
C.�ﵽƽ������ں�����ѹ�������������ϵ�������Ũ������
D.���ݱ������ݣ�����![]() ʱ�ķֽ�ƽ�ⳣ��ԼΪ
ʱ�ķֽ�ƽ�ⳣ��ԼΪ![]()