题目内容
3.室温下,将1mol的CuSO4•5H2O(s)溶于水会使溶液温度降低,热效应为△H1,将1mol的CuSO4溶于水会使溶液温度升高,热效应为△H2;CuSO4•5H2O(s)受热分解的化学方程式为CuSO4•5H2O(s)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4(s)+5H2O(l),热效应为△H3.则下列判断正确的是( )| A. | △H2>△H3 | B. | △H1<△H3 | C. | △H1+△H3=△H2 | D. | △H1+△H2>△H3 |
分析 胆矾溶于水时,溶液温度降低,该反应为吸热反应,则:CuSO4•5H2O(s)=Cu2+(aq)+SO42-(aq)+5H2O(l)△H1>0;
硫酸铜溶于水,溶液温度升高,说明该反应为放热反应,则:CuSO4(s)=Cu2+(aq)+SO42-(aq)△H2<0;
已知CuSO4•5H2O(s)=CuSO4(s)+5H2O(l)△H3,根据盖斯定律确定各焓变之间的关系,以此解答该题.
解答 解:①胆矾溶于水时,溶液温度降低,反应为CuSO4•5H2O(s)=Cu2+(aq)+SO42-(aq)+5H2O(l)△H1>0;
②硫酸铜溶于水,溶液温度升高,该反应为放热反应,则:CuSO4(s)=Cu2+(aq)+SO42-(aq)△H2<0;
③已知CuSO4•5H2O(s)=CuSO4(s)+5H2O(l)△H3;
依据盖斯定律①-②得到③:△H3=△H1-△H2,由于△H2<0,△H1>0,则△H3>0,
A.分析可知△H3>0,而△H2<0,则△H3>△H2,故A错误;
B.上述分析可知:△H2<0,△H3>0,则△H2<△H3,故B正确;
C.△H3=△H1-△H2,则△H1=△H3+△H2,故C错误;
D.△H2<0,△H1>0,且△H1=△H3+△H2,则△H3>△H1+△H2,故D错误;
故选B.
点评 本题考查化学反应与能量变化,为高频考点,侧重考查盖斯定律在热化学方程式计算中的应用,题目难度中等,根据盖斯定律分析物质溶解过程中的能量变化是解题关键,注意明确盖斯定律的内容及热化学方程式的书写原则.

练习册系列答案
相关题目
13.下列说法中正确的是( )
| A. | s区都是金属元素 | B. | 所有非金属元素都在p区 | ||
| C. | 稀有气体在ds区 | D. | s区都是主族元素 |
14.关于反应2Na2O2+2CO2═2Na2CO3+O2 的下列说法正确的是( )
| A. | CO2是还原剂,在该反应中被氧化 | |
| B. | Na2O2是氧化剂,在该反应中发生氧化反应 | |
| C. | 氧化剂和还原剂的物质的量之比为1:2 | |
| D. | 若有2 mol Na2O2参加反应,则有2 mol电子转移 |
11.某溶液中含有下列离子Na+、Fe3+、Cl-、Fe2+、Al3+ 向其中先加入足量的Na2O2,然后微热并搅拌,再加入足量的稀盐酸原溶液中离子物质的量基本不变的为( )
| A. | Al3+ | B. | Fe3+ | C. | Cl- | D. | Fe2+ | ||||
| E. | Na+ |
8.把铁片放入下列溶液中,铁片溶解,溶液质量增加,反应又没有气体放出的是( )
| A. | 硝酸钠溶液 | B. | 硫酸铜溶液 | C. | 稀硫酸 | D. | 氯化铁溶液 |
15.在①Al ②Al2O3 ③Al(OH)3 ④NaHCO3四种物质中,既能与硫酸反应又能和氢氧化钠反应的化合物是( )
| A. | ②③④ | B. | ①②③④ | C. | ①③④ | D. | ①②④ |
12.已知下列反应:
反应Ⅰ:Co2O3+6HCl(浓)=2CoCl2+Cl2↑+3H2O
反应Ⅱ:5Cl2+I2+6H2O=10HCl+2HIO3 下列说法正确的是( )
反应Ⅰ:Co2O3+6HCl(浓)=2CoCl2+Cl2↑+3H2O
反应Ⅱ:5Cl2+I2+6H2O=10HCl+2HIO3 下列说法正确的是( )
| A. | 反应Ⅰ中HCl是氧化剂 | B. | 反应Ⅱ中Cl2被氧化,发生氧化反应 | ||
| C. | 还原性:CoCl2>HCl>I2 | D. | 氧化性:Co2O3>Cl2>HIO3 |
4.已知M是中学化学常见金属,下列对离子反应通式Mm++mOH-=M(OH)m↓的推断中正确的是( )
| A. | 若m=1,则M(NO3)m溶液和氨水互滴时的现象可能不同 | |
| B. | 若m=2,则在空气中蒸干、灼烧MSO4溶液一定能得到MSO4 | |
| C. | 若m=3,则MCl3与足量氢氧化钠溶液反应一定生成M(OH)m | |
| D. | Mm+离子一定不能与酸反应 |
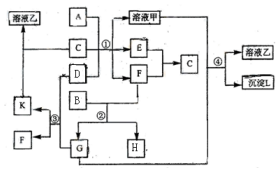 如图表示常见的单质及其化合物之间的转化关系,其中A为常见的金属单质,B为非金属单质(一般是黑色粉末),C是常见的无色无味液体,D是淡黄色的固体化合物.(反应条件图中已省略).
如图表示常见的单质及其化合物之间的转化关系,其中A为常见的金属单质,B为非金属单质(一般是黑色粉末),C是常见的无色无味液体,D是淡黄色的固体化合物.(反应条件图中已省略).