题目内容
【题目】(一)写出下列反应的化学方程式:
(1)实验室制乙烯__________________________________
(2)用甲苯制备TNT________________________________
(3)苯酚和浓溴水的反应_____________________________
(4)1,2-二溴乙烷与其足量氢氧化钠的乙醇溶液加热:____________________________
(5)乙醛与银氨溶液的反应____________________________
(二)(1)根据系统命名法,![]() 的名称是_________________
的名称是_________________![]() 的名称是_________________________________________________;
的名称是_________________________________________________;
(2) 顺-2-丁烯的结构简式是________________
(3)已知:室温下H2YO3的电离平衡常数Ka1=1.4×10-2,Ka2=6.3×10-8,NaHYO3溶液中离子浓度从大到小的顺序是_________________________________
(4) 某同学取出10 mL 0.010 mol·L-1氨水,用pH试纸测其pH=a,然后用蒸馏水稀释至1 000 mL,再用pH试纸测其pH=b,若要确认NH3·H2O是弱电解质,则a、b值应满足的关系是________。
(5)25 ℃时,将a mol·L-1氨水与0.01 mol·L-1盐酸等体积混合,反应平衡时溶液中c(NH4+)=c(Cl-),用含a的代数式表示NH3·H2O的电离常数Kb=________。
【答案】CH3CH2OH ![]() CH2=CH2 +H2O
CH2=CH2 +H2O ![]() +3HNO3
+3HNO3![]()
 +3H2O
+3H2O ![]() +3Br2---→
+3Br2---→  ↓+3HBr BrCH2CH2Br+2NaOH
↓+3HBr BrCH2CH2Br+2NaOH![]() CH≡CH↑+2NaBr+2H2O CH3CHO+2Ag(NH3)2OH
CH≡CH↑+2NaBr+2H2O CH3CHO+2Ag(NH3)2OH![]() CH3COONH4+3NH3+2Ag+H2O。 2-甲基-3-乙基戊烷 5-甲基-2-庚烯
CH3COONH4+3NH3+2Ag+H2O。 2-甲基-3-乙基戊烷 5-甲基-2-庚烯 ![]() C(Na+)>C(HYO3-)>C(H+)>C(YO32-)>C(OH-) a-2<b<a 10-9/(a-0.01)
C(Na+)>C(HYO3-)>C(H+)>C(YO32-)>C(OH-) a-2<b<a 10-9/(a-0.01)
【解析】
(一)(1)乙醇与浓硫酸加热制取乙烯;
(2)甲苯与浓硫酸、浓硝酸,加热制备TNT;
(3)苯酚和浓溴水反应生成2,4,6-三溴苯酚白色沉淀和氢溴酸;
(4)1,2-二溴乙烷与足量氢氧化钠的乙醇溶液加热发生消去反应生成乙炔,溴化钠和水;
(5)乙醛与银氨溶液的反应生成乙酸铵、水、Ag、氨气。
(二)(1)根据烷烃命名原则:①长-----选最长碳链为主链;②多-----遇等长碳链时,支链最多为主链;③近-----离支链最近一端编号;④小-----支链编号之和最小.看下面结构简式,从右端或左端看,均符合“近-----离支链最近一端编号”的原则;⑤简-----两取代基距离主链两端等距离时,从简单取代基开始编号.如取代基不同,就把简单的写在前面,复杂的写在后面命名;
(2)烯烃命名原则:①首先选择含有双键的最长碳链作为主链,按主链中所含碳原子的数目命名为某烯; ②给主链编号时从距离双键最近的一端开始,侧链视为取代基,双键的位次须标明,用两个双键碳原子位次较小的一个表示,放在烯烃名称的前面. ③其它同烷烃的命名规则;
(2)顺-2-丁烯,主链为丁烯,两个甲基位于双键的同侧;
(3)将HYO3-的水解常数与电离常数进行对比,先确定溶液酸碱性,再比较离子浓度大小;
(4) 若NH3·H2O是强电解质,用蒸馏水稀释至1 000 mL,其pH=a-2。因为NH3·H2O是弱电解质,存在电离平衡,a、b应满足a-2<b<a。
(5)在25℃下,平衡时溶液中c(NH4+)=c(Cl-)=0.005mol/L,根据物料守恒得n(NH3.H2O)=(0.5a-0.005)mol/L,根据电荷守恒得c(H+)=c(OH-)=10-7mol/L,溶液呈中性,NH3H2O的电离常数Kb=![]() 计算。
计算。
(一)(1)乙醇与浓硫酸加热发生消去反应制取乙烯:CH3CH2OH ![]() CH2=CH2 +H2O
CH2=CH2 +H2O
答案:CH3CH2OH ![]() CH2=CH2 +H2O
CH2=CH2 +H2O
(2)用甲苯与浓硫酸、浓硝酸,加热制备TNT:
![]() +3HNO3
+3HNO3![]()
 +3H2O;
+3H2O;
答案:![]() +3HNO3
+3HNO3![]()
 +3H2O
+3H2O
(3)苯酚和浓溴水反应生成2,4,6-三溴苯酚白色沉淀和氢溴酸;![]() +3Br2---→
+3Br2---→  ↓+3HBr ;
↓+3HBr ;
答案:![]() +3Br2---→
+3Br2---→  ↓+3HBr
↓+3HBr
(4)1,2-二溴乙烷与其足量氢氧化钠的乙醇溶液加热发生消去反应生成乙炔,溴化钠和水:BrCH2CH2Br+2NaOH![]() CH≡CH↑+2NaBr+2H2O;
CH≡CH↑+2NaBr+2H2O;
答案:BrCH2CH2Br+2NaOH![]() CH≡CH↑+2NaBr+2H2O
CH≡CH↑+2NaBr+2H2O
(5)乙醛与银氨溶液的反应生成乙酸铵、水、Ag、氨气:CH3CHO+2Ag(NH3)2OH![]() CH3COONH4+3NH3+2Ag+H2O。
CH3COONH4+3NH3+2Ag+H2O。
答案:CH3CHO+2Ag(NH3)2OH![]() CH3COONH4+3NH3+2Ag+H2O。
CH3COONH4+3NH3+2Ag+H2O。
(二)(1)根据烷烃命名规则编号命名 2-甲基-3-乙基戊烷;
2-甲基-3-乙基戊烷;
答案:2-甲基-3-乙基戊烷
(2)根据烯烃命名规则编号命名 5-甲基-2-庚烯;
5-甲基-2-庚烯;
答案:5-甲基-2-庚烯
(2)顺-2-丁烯,主链为丁烯,两个甲基位于双键的同侧,结构简式![]() ;
;
答案:![]()
(3)HYO3-的水解常数Kh=KW/Ka1=(1×10-14)/1.4×10-2=7.14×10-13,由于Kh<Ka2,所以HYO3-的电离平衡大于水解平衡,溶液显酸性,根据HYO3-![]() H++YO32- ,H2O
H++YO32- ,H2O![]() H++OH-
H++OH-
答案:C(Na+)>C(HYO3-)>C(H+)>C(YO32-)>C(OH-)
(4) 若NH3·H2O是强电解质,用蒸馏水稀释至1 000 mL,其pH=a-2。因为NH3·H2O是弱电解质,存在电离平衡,a、b应满足a-2<b<a;
答案:a-2<b<a
(5)在25℃下,平衡时溶液中c(NH4+)=c(Cl-)=0.005mol/L,根据物料守恒得n(NH3.H2O)=(0.5a-0.005)mol/L,根据电荷守恒得c(H+)=c(OH-)=10-7mol/L,溶液呈中性,NH3H2O的电离常数Kb=![]() =
=![]() =10-9/(a-0.01);
=10-9/(a-0.01);
答案:10-9/(a-0.01)

【题目】在花瓶中加入“鲜花保鲜剂”可延长鲜花的寿命。下表是1 L“鲜花保鲜剂”的成分,阅读后并回答下列问题:
成分 | 质量/g | 摩尔质量/(g·mol-1) |
蔗糖 | 50.00 | 342 |
硫酸钾 | 0.50 | 174 |
阿司匹林 | 0.35 | 180 |
高锰酸钾 | 0.50 | 158 |
硝酸银 | 0.04 | 170 |
(1)“鲜花保鲜剂”中物质的量浓度最大的成分是__________(填写名称)。
(2)“鲜花保鲜剂”中K+的物质的量浓度为(阿司匹林中不含K+)__________________(只要求写表达式,不需计算)mol·L-1。
(3)下图所示的仪器中,在配制“鲜花保鲜剂”溶液时肯定不需要的是________(填字母),还缺少的玻璃仪器有__________________(填仪器名称)。
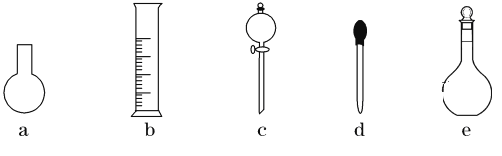
(4)配制过程中,下列操作对配制结果没有影响的是__________(填字母)。
A.容量瓶在使用前未干燥,里面有少量蒸馏水
B.定容时仰视液面
C.容量瓶在使用前刚刚配制完一定物质的量浓度的NaCl溶液而未洗净
D.定容摇匀后发现液面低于容量瓶的刻度线,但未做任何处理
(5)欲确定“鲜花保鲜剂”中硝酸银的浓度,可加入的试剂中要含有__________。(填化学符号)
【题目】实验室制取氯气除了用浓盐酸和二氧化锰反应外还可利用下列反应:KClO3+6HCl(浓)═KCl+3Cl2↑+3H2O,该反应的优点是反应产生氯气速度快、不需加热。下图是实验室利用此反应制备氯气并进行一系列相关实验的装置(夹持设备已略)。
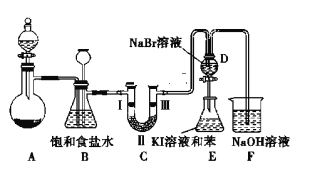
(1)装置B的作用是______ ,实验进行时C中可能发生堵塞,请写出发生堵塞时B中的现象:_______。
(2)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ依次放入______ (选“a”“b”或“c”)
a | b | c | |
Ⅰ | 干燥的有色布条 | 湿润的有色布条 | 干燥的有色布条 |
Ⅱ | 碱石灰 | 浓硫酸 | 无水氯化钙 |
Ⅲ | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
(3)设计装置D、E 的目的是为了比较Cl2、Br2、I2的氧化性强弱.已知Br2的水溶液因浓度不同而呈现橙色或红棕色,I2难溶于水而易溶于苯,且I2的苯溶液为紫红色.当向D中缓缓通入足量Cl2时,可以看到无色溶液逐渐变为红棕色,说明Cl2的氧化性大于Br2,请写出D中对应的离子方程式并用单线桥法表示出电子转移情况:_________ 。打开活塞,将 D中的少量溶液加入E中,振荡E,观察到E中溶液分为两层,上层(苯层)为紫红色.该现象______ (填“能”或“不能”)说明 Br2的氧化性大于I2。
(4)装置F的作用是除去污染性的物质(Cl2、Br2等),已知 Cl2与NaOH反应时产物中可能有NaCl、NaClO、NaClO3,且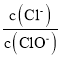 值与温度高低有关.若烧杯中装有500mL 0.2mol/L 的NaOH溶液,则最多可吸收标况下的Cl2的体积为______ L(忽略Cl2溶于水)。
值与温度高低有关.若烧杯中装有500mL 0.2mol/L 的NaOH溶液,则最多可吸收标况下的Cl2的体积为______ L(忽略Cl2溶于水)。
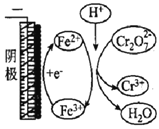
【题目】用电解法处理含Cr2O72-的废水,探究不同因素对含Cr2O72-废水处理的影响,结果如表所示(Cr2O72-的起始浓度、体积、电压、电解时间均相同)。下列说法错误的是
实验 | i | ii | iii | iv |
|
是否加入Fe2(SO4)3 | 否 | 否 | 加入30g | 否 | |
是否加入H2SO4 | 否 | 加入1mL | 加入1mL | 加入1mL | |
阴极村料 | 石墨 | 石墨 | 石墨 | 石墨 | |
阳极材料 | 石墨 | 石墨 | 石墨 | 铁 | |
Cr2O72-的去除率 | 0.092% | 12.7% | 20.8% | 57.3% | 实验iii中Fe3+去除Cr2O72-的机理 |
A. 实验ⅱ与实验i对比,其他条件不变,增加c(H+)有利于Cr2O72-的去除
B. 实验ⅲ与实验ⅱ对比,其他条件不变,增加c(Fe3+)有利于Cr2O72-的去除
C. 实验ⅳ中Fe2+循环利用提高了Cr2O72-的去除率
D. 若实验ⅳ中去除0.01 mol Cr2O72-,生成的阳离子全部转化成沉淀,则沉淀的质量是2.06g