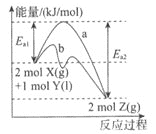
题目内容
【题目】化学上常利用周期表中同族元素的相似性与递变性研究元素的原子结构和性质。回答下列问题:
(1)现代化学中,常利用_____特征谱线来鉴定元素。
(2)氧族元素中,氧、硫、硒三元素的第一电离能由大到小的顺序为_____(用元素符号回答),气态SO3为单分子状态,其分子空间构型为_____。若SO3的三聚体(SO3)3的环状结构如图所示,则该结构中S原子的杂化轨道类型为_____。
(3)卤族元素的氢化物中,H﹣F键的键能>H﹣Cl键的键能>H﹣Br键的键能,原因是_____。
(4)铁、钴、镍同处在元素周期表中_____族,它们的阳离子易形成各种配合物,已知:磁矩u=![]() ,n为中心原子或离子的单电子数,实验测得配合物[Co(NH3)4Cl2]Cl中u=0,则其中心粒子的化合价为_____,其价电子排布图为_____。
,n为中心原子或离子的单电子数,实验测得配合物[Co(NH3)4Cl2]Cl中u=0,则其中心粒子的化合价为_____,其价电子排布图为_____。
(5)已知:铜晶体为面心立方最密堆积,铜原子半径为rpm,阿伏加德罗常数用NA表示,则铜晶体密度的计算式为_____。

【答案】原子光谱 O>S>Se 平面正三角形 sp3 由于原子半径r(F)<r(Cl)<r(Br),故H﹣F、H﹣Cl、H﹣Br的键长逐渐增大,核对成键电子对的吸引力逐渐减小,故键能逐渐增大 Ⅷ +3 ![]()
 gcm﹣3
gcm﹣3
【解析】
(1)现代化学中,常利用原子光谱特征谱线来鉴定元素;
(2)同主族自上而下第一电离能减小,故第一电离能:O>S>Se;SO3中心原子S原子孤电子对数=![]() =0,价层电子对数=0+3=3,所以分子空间构型平面正三角形;根据(SO3)3的环状结构图,黑色球为S原子,白色球为O原子,S原子形成4个单键,价层电子对数为4,S原子采取sp3杂化,;
=0,价层电子对数=0+3=3,所以分子空间构型平面正三角形;根据(SO3)3的环状结构图,黑色球为S原子,白色球为O原子,S原子形成4个单键,价层电子对数为4,S原子采取sp3杂化,;
(3)由于原子半径r(F)<r(Cl)<r(Br),故H﹣F、H﹣Cl、H﹣Br的键长逐渐增大,核对成键电子对的吸引力逐渐减小,故键能逐渐增大;
(4)铁、钴、镍同处在元素周期表中Ⅷ族;配合物中,金属元素提供空轨道,为中心粒子,根据化合价代数和为0,可知Co元素的化合价为+3价;由u=0,可知钴离子中没有单电子,则Co3+的价电子排布图为:![]() ;
;
(5)铜晶体为面心立方最密堆积,处于面对角线上的Cu原子相邻,铜原子半径为r pm,则晶胞边长=![]() pm,则晶胞的体积V=(
pm,则晶胞的体积V=(![]() ×10-10)3cm3,晶胞中Cu原子数目=8×
×10-10)3cm3,晶胞中Cu原子数目=8×![]() +6×
+6×![]() =4,晶胞质量m=
=4,晶胞质量m=![]() g,晶体密度=
g,晶体密度=![]() g÷(
g÷(![]() ×10-10)3cm3=
×10-10)3cm3= gcm﹣3。
gcm﹣3。

 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案